中山大学大学发表最新EB病毒方面的Nature论文
来源:生物世界 2025-06-20 09:53
该研究提出,R9AP 是 EBV 感染 B 细胞和上皮细胞的关键通用受体,可作为预防 EBV 感染的潜在新靶点,为开发高效抗 EBV 疫苗奠定了基础。
EB 病毒(EBV)持续感染着超过 90% 的人类,导致传染性单核细胞增多症、自身免疫疾病(例如多发性硬化症、系统性红斑狼疮)以及多种上皮细胞或 B 细胞来源的恶性肿瘤(例如鼻咽癌、EBV相关性胃癌、霍奇金淋巴瘤及伯基特淋巴瘤等)。
EBV 通过其病毒糖蛋白与不同宿主受体的相互作用感染上皮细胞和 B 细胞,但一直不清楚是否存在一种通用受体介导其对这两种主要宿主细胞的感染。
2025 年 6 月 18 日,中山大学肿瘤防治中心曾木圣教授、钟茜教授团队在国际顶尖学术期刊 Nature 上发表了题为:R9AP is a common receptor for EBV infection in epithelial cells and B cells 的研究论文。
该研究突破了传统上两种细胞受体应截然不同的固有认识,首次发现了 R9AP 这一分子在上皮细胞和 B 细胞这两种细胞类型中均表达,并作为 EBV 感染这两种细胞的关键通用受体,为预防 EBV 感染提供了潜在新靶点,为开发高效抗 EBV 疫苗奠定了基础。

EB 病毒(EBV)是一种致癌病毒,其对 B 细胞和上皮细胞具有高度嗜性,EBV 每年约导致 20 万例癌症,其中 B 细胞癌和上皮细胞癌的数量大致相当。
有研究认为,EBV 利用多种病毒糖蛋白和不同的宿主受体来感染人类 B 细胞和上皮细胞。EBV 对 B 细胞的附着取决于 gp350 与 CR2(也称为 CD21)或 CD35 之间的相互作用。gp42 与 gH/gL 形成复合物,与 HLA-II 类分子相互作用,从而触发 EBV 融合素 gB 促使其进入 B 细胞。
相比之下,EBV 对上皮细胞的感染则更为复杂。作为核心融合机制的成员,gH/gL 和 gB 对上皮细胞感染也是必需的。然而,尽管 gp42 对 B 细胞的摄取至关重要,但它却抑制 EBV 对上皮细胞的感染.此外,上皮细胞通常不表达 CR2、CD35 或 HLA-Ⅱ 类分子。相反,有研究认为,EPHA2、NRP1、整合素和 Myosin-9 通过多步骤过程驱动 EBV 对上皮细胞的感染。
然而,gH/gL 中和抗体 AMMO1 能够阻断 EBV 对上皮细胞和 B 细胞的感染,这表明可能存在一种 EBV 摄取的通用机制,通过一种未被识别的通用型细胞受体介导 EBV 进入上皮细胞和 B 细胞。
在这项最新研究中,研究团队揭示了 R9AP 蛋白(由 RGS9BP 基因编码)是 EBV 感染上皮细胞和 B 细胞的关键受体,其与 gH/gL 的相互作用会被中和抗体 AMMO1 所破坏。
R9AP 的沉默或敲除、R9AP 衍生多肽以及 R9AP 单克隆抗体均显著抑制上皮细胞和 B 细胞对 EBV 的摄取,而 R9AP 过表达则促进这两种细胞类型对 EBV 的摄取。R9AP 直接与 EBV 的糖蛋白 gH/gL 复合物结合,以启动 gH/gL-gB 介导的膜融合。
值得注意的是,R9AP 与 gH/gL 的相互作用会被高度竞争性的 gH/gL 中和抗体 AMMO1 抑制,该抗体可阻止 EBV 进入上皮细胞和 B 细胞。此外,R9AP 分别与 EBV gp42-HLA-II 类复合物或 gH/gL-EPHA2 复合物在 B 细胞或上皮细胞中协同介导的病毒和细胞膜融合。
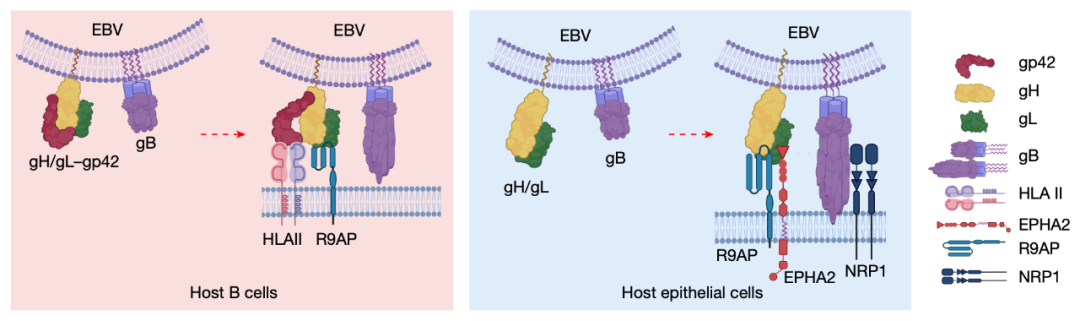
总的来说,该研究提出,R9AP 是 EBV 感染 B 细胞和上皮细胞的关键通用受体,可作为预防 EBV 感染的潜在新靶点,为开发高效抗 EBV 疫苗奠定了基础。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


