Cell:汪铭团队开发靶向蛋白降解新技术SupTAC,首次实现体内时空可控的靶向蛋白质降解
来源:生物世界 2026-01-18 14:36
该研究开发了超分子靶向嵌合体(SupTAC)技术,首次在活体动物模型中实现可编程、时空可控的靶向蛋白质降解,为蛋白质稳态调控与疾病治疗研究开辟了新路径。
近年来,包括分子胶、蛋白靶向降解嵌合体(PROTAC)等在内的靶向蛋白降解(Targeted protein degradation,TPD)技术已崭露头角,成为颇具前景的治疗手段,其依赖于泛素蛋白酶体系统(UPS)来降解蛋白质,彻底改变了基础生物学和药物研发中调控蛋白质功能的策略。
然而,现有蛋白质降解技术在体内应用时,往往难以同时兼顾时间选择性和空间选择性,导致降解效率受限,并面临脱靶风险。
因此,如何在复杂生命体系中实现蛋白质降解的时空精准调控,是化学生物学和生命科学研究的核心挑战之一。
2026 年 1 月 16 日,中国科学院化学研究所汪铭团队在国际顶尖学术期刊 Cell 上发表了题为:Multimodal supramolecular targeting chimeras enable spatiotemporally resolved protein degradation in vivo 的研究论文。
该研究开发了超分子靶向嵌合体(SupTAC)技术,首次在活体动物模型中实现可编程、时空可控的靶向蛋白质降解,为蛋白质稳态调控与疾病治疗研究开辟了新路径。

在这项最新研究中,研究团队报道了超分子靶向嵌合体(Supramolecular Targeting Chimera,SupTAC),这是一种模块化且可编程的平台,能够在体内实现组织特异性和时间可控的蛋白质降解。
SupTAC 自组装成超分子纳米颗粒(SNP),使靶标结合配体和 E3 连接酶招募剂共定位,从而通过多价超分子邻近效应促进蛋白酶体降解。该策略在包括非人灵长类动物在内的多种物种中实现了稳健且组织特异性的蛋白降解,包括肝脏和肺部的特异性。
作为概念验证,在急性肺损伤的小鼠模型中,利用 SupTAC 特异性降解肺部中的 ACSL4 蛋白,有效减轻了肺部细胞的铁死亡和肺部炎症。
通过整合模块化、组织特异性和时间调控,SupTAC 建立了一个多功能平台,用于精确控制蛋白质降解,以探究动态信号网络并开发靶向治疗药物。
该研究的亮点:
SupTAC 提供了一个模块化且可编程的平台,用于靶向蛋白降解;
SupTAC 实现了时空分辨率的体内蛋白降解;
SupTAC 在非人灵长类动物中展示了组织特异性蛋白降解;
肺部特异性降解 ACSL4 能有效抑制肺部细胞的铁死亡。
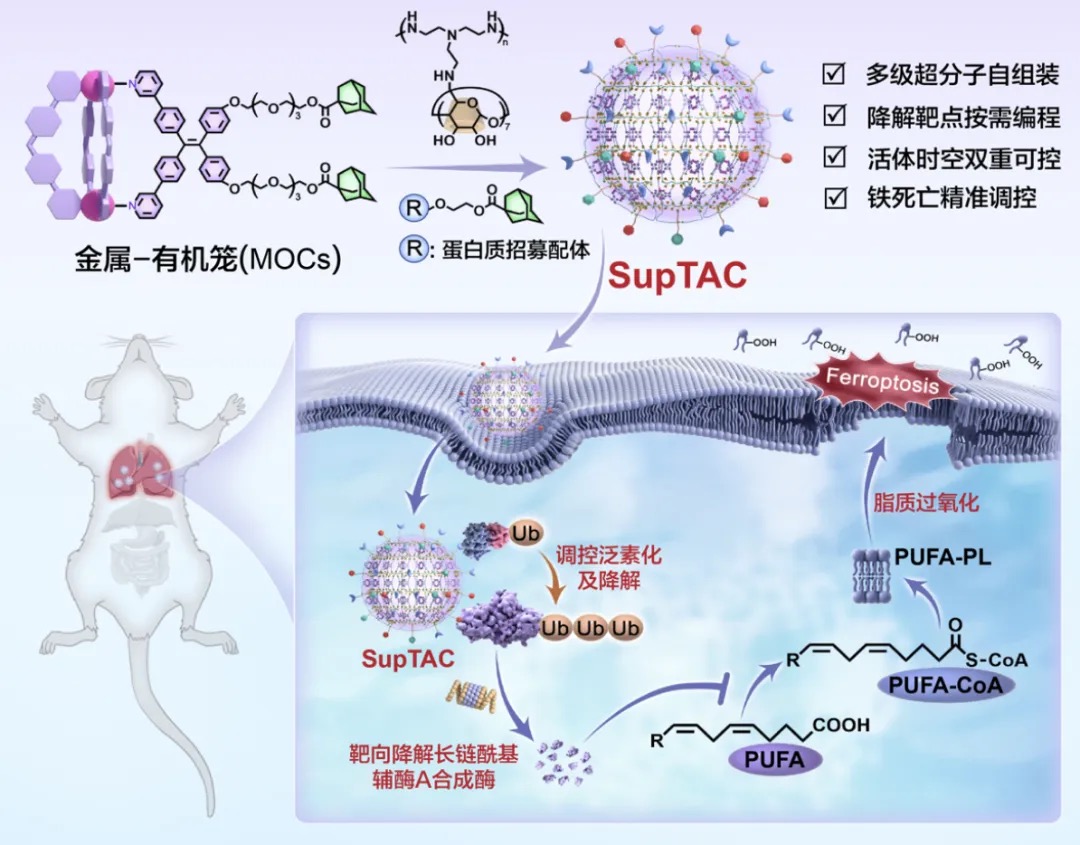
SupTAC 实现活体内时空可控的蛋白质降解
总的来说,该研究深度融合了超分子化学与化学生物学,突破了传统靶向蛋白降解技术在时空调控的局限,不仅为复杂生命体系中蛋白质稳态调控提供了全新策略,更在疾病机制解析、创新药物靶点发现等领域展现出巨大应用潜力,有望推动靶向蛋白质降解技术向临床转化迈出关键一步。
论文链接:https://www.cell.com/cell/abstract/S0092-8674(25)01420-5
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


