《自然》:自闭症患者大脑变化的广泛性,远超以往认知!
来源:奇点糕 2022-12-01 18:11
这项研究通过一个更大规模的涵盖ASD患者大脑皮层四个小叶的样本队列,证明了转录失调在ASD患者大脑皮层中广泛存在,并且靠后区域的转录失调比靠前区域严重,而这种广泛的转录失调背后是皮层中细胞类型特异的基
神经精神疾病一直以来缺乏明确的脑病理,并且在很大程度上受遗传调控,ASD(自闭症谱系障碍)作为其中的一类疾病也不例外,所涉及的风险基因多达上百个,因此患者发病的病因有很大的异质性[1,2]。
最近的一些研究报道了大部分ASD患者大脑额叶皮层和颞叶皮层中存在一致的转录组和表观组异常调控模式,这表明ASD尽管病因异质性较大却可能有较为一致的分子病理[3,4]。但ASD中一致性的分子病理究竟是只限于大脑皮层局部,还是广泛存在于大脑皮层中仍然需要进一步的研究。
近日,由加州大学洛杉矶分校的Daniel H. Geschwind和Michael J. Gandal领衔的研究团队,在《自然》期刊上发表重要研究成果[5]。
他们分析了725份来自112个ASD患者以及正常人遗体的大脑样本,涵盖11个不同的大脑皮层区域,利用样本的RNA测序数据,他们发现在大脑皮层中存在广泛的转录组变化,并且呈现出从前到后(额叶到枕叶)越发明显的趋势,这比以前所知的要广泛得多。后续的单核RNA测序数据和甲基化谱则表明,上述分子特征主要影响了兴奋性神经元以及神经胶质细胞。
研究人员还认为,这个研究表明,大脑中的广泛的RNA变化可能是ASD的原因,而不是这种疾病的结果[6]。

论文首页截图
Geschwind团队首先对725份涵盖11个大脑皮层区域(其中包含了额叶、顶叶、颞叶、枕叶四个皮层小叶)的样本进行了RNA测序,这个样本量几乎是以往研究的3倍,这些样本来自49个ASD患者的遗体和54个相匹配的健康人遗体。
得益于样本量增加带来的统计力增大,研究人员通过比较两组样本的基因表达谱,以及由可变剪接产生的同一个基因的不同转录本的表达水平,发现了4223个基因以及9474个转录本在整个大脑皮层范围有显著的差异表达,并且基因转录本的差异效应比基因要大,表明可变剪接ASD中有着重要作用。
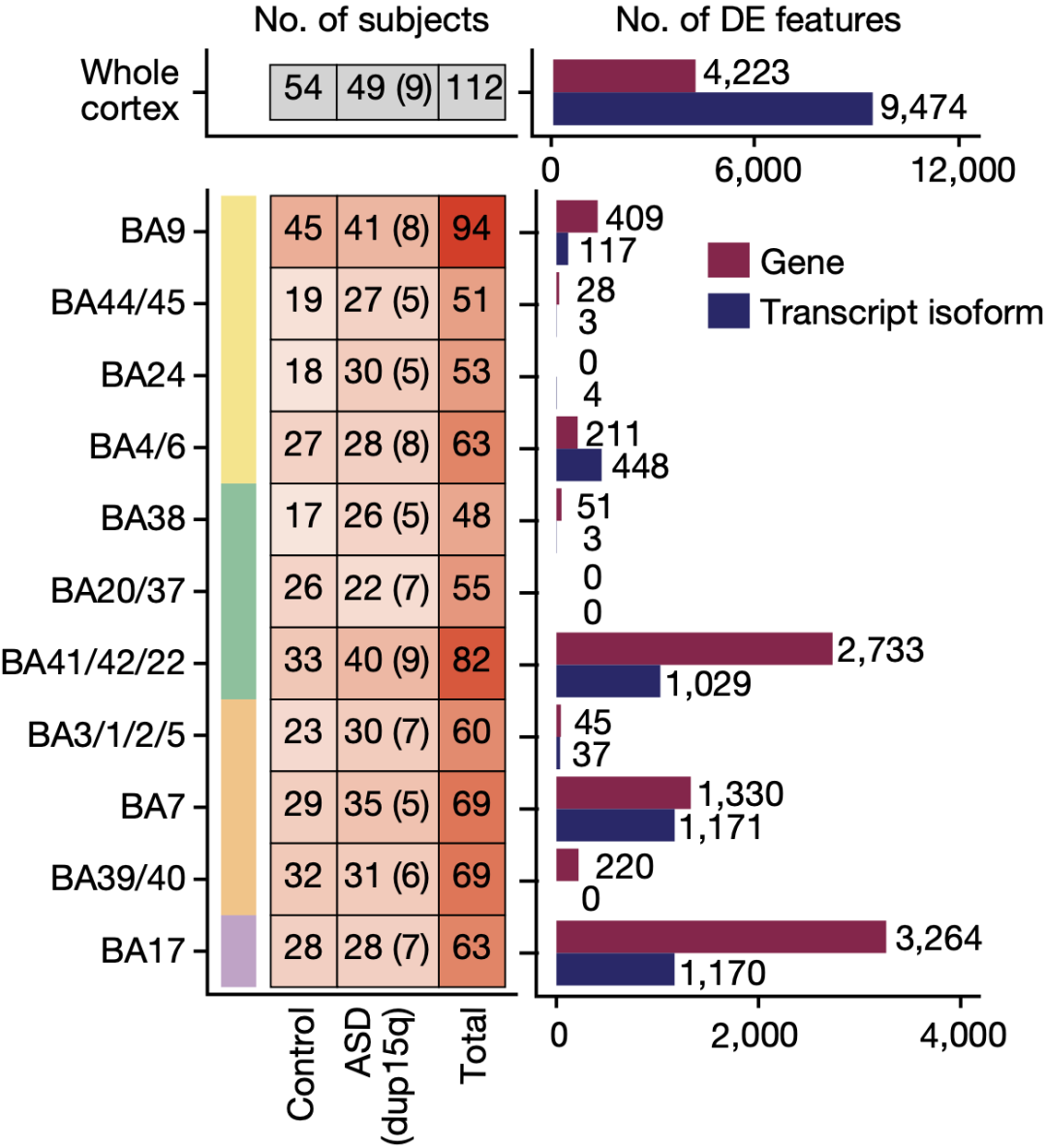
各个皮层区域以及皮层整体上的ASD患者和正常人之间的差异表达基因和转录本数量
为了比较各个皮层区域与皮层整体上的一致性,研究人员计算了各个皮层区域中的ASD患者和正常人之间的差异表达基因和转录本。
尽管各个皮层区域的差异表达基因和转录本数量不一致,但是11个皮层区域的基因差异效应大小与皮层整体是一致的。其中位于枕叶的初级视皮层(BA17)最明显,BA17有3264个差异表达基因,而有59%都是皮层整体上的差异表达基因。
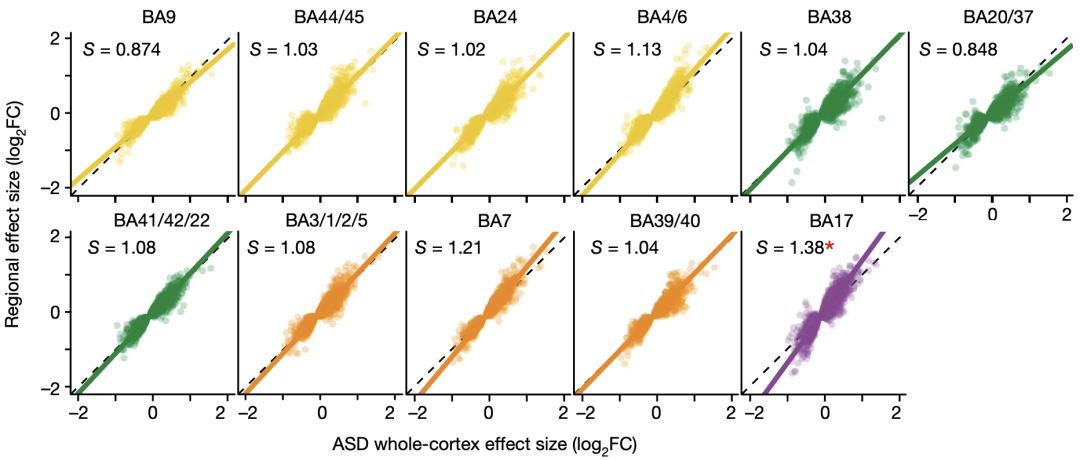
皮层各个区域与皮层整体基因差异效应大小的一致性
Geschwind团队还在83份来自9例母源15q11-q13重复综合征(是ASD的一种常见类型)患者遗体的大脑皮层样本中,进行了上述的差异表达分析,他们发现这些样本中的基因差异效应与前面皮层整体基因差异效应是一致的。
上述研究结果表明,ASD患者大脑皮层中的转录失调所呈现的分子病理广泛存在于大脑皮层的各个区域,而并不只限于局部。
在正常人的大脑组织中,皮层的各个区域之间存在差异明显的基因表达模式,这主要反映了不同区域的细胞结构和功能的差异。Geschwind团队在之前发表的工作中报道了ASD患者的额叶皮层和颞叶皮层之间差异表达的基因显著减少,他们将这种现象称为皮层不同区域的转录组特性衰减(ARI)。ARI表明ASD患者的额叶皮层以及颞叶皮层的功能,以及区域之间的连通性发生了变化。
为了探究ARI是否在ASD患者大脑皮层中广泛存在,研究人员在正常人样本和ASD患者样本中分别选取了相应的55对不同的皮层区域,通过比较不同区域的基因表达谱,分别计算正常人和ASD患者相对应的不同皮层区域之间的差异表达基因数量,得到ARI的量化描述,然后再以正常样本和患者样本之间本身的差异表达基因数量分布,作为背景来衡量ARI的显著性。
最后研究人员发现了10对皮层区域之间发生显著的ARI,这表明ASD患者的大脑皮层更倾向于分子水平同质化。在10对发生显著ARI的区域中有9对都包括了BA17或者BA39/40。
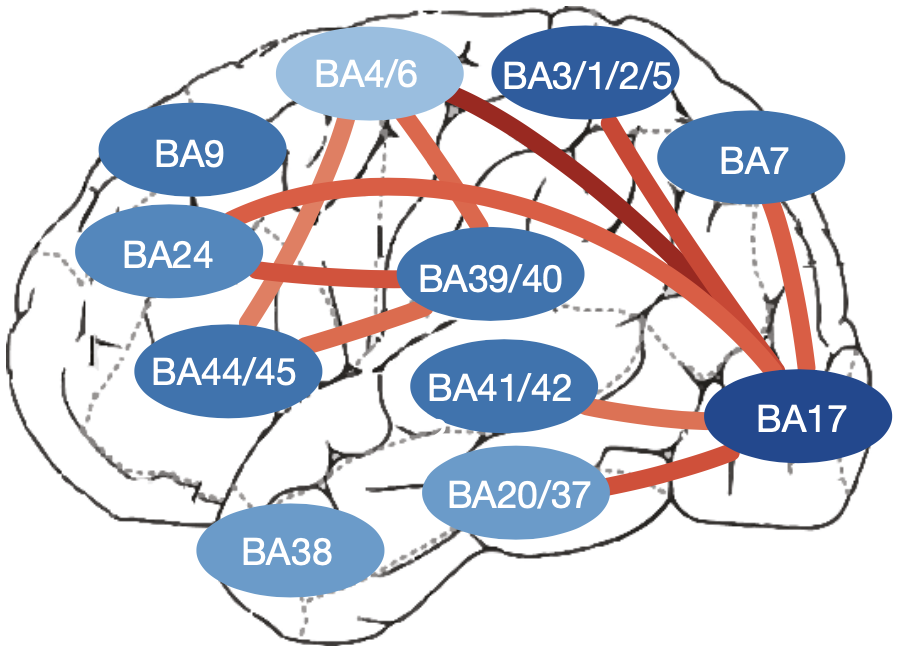
发生显著ARI的10对皮层区域
为了研究发生ARI皮层区域中基因表达的变化,研究人员根据区域间基因差异效应以及相应的正常样本和患者样本间的差异效应,选出了导致ARI的代表性基因。
尽管这些基因在皮层各个区域中存在广泛的异常调控,但是在靠后的区域BA17和BA39/40中表现出了更大的变化,即正常人样本中原本应该在BA17和BA39/40中出现相对于其他区域更高或更低的表达的基因,在ASD患者样本中则和其他区域的表达量几乎一致。
Geschwind团队还对ARI基因作了进一步的分析,他们按照在正常人样本的皮层区域中从前到后表达量升高或者降低,而在ASD患者样本的各个皮层区域不发生变化,将ARI基因分为了ARI上调基因和ARI下调基因。他们发现,不论哪一类基因在皮层靠后的区域(BA17、BA39/40)中,ASD患者样本相对与正常人样本都有着更大的变化。
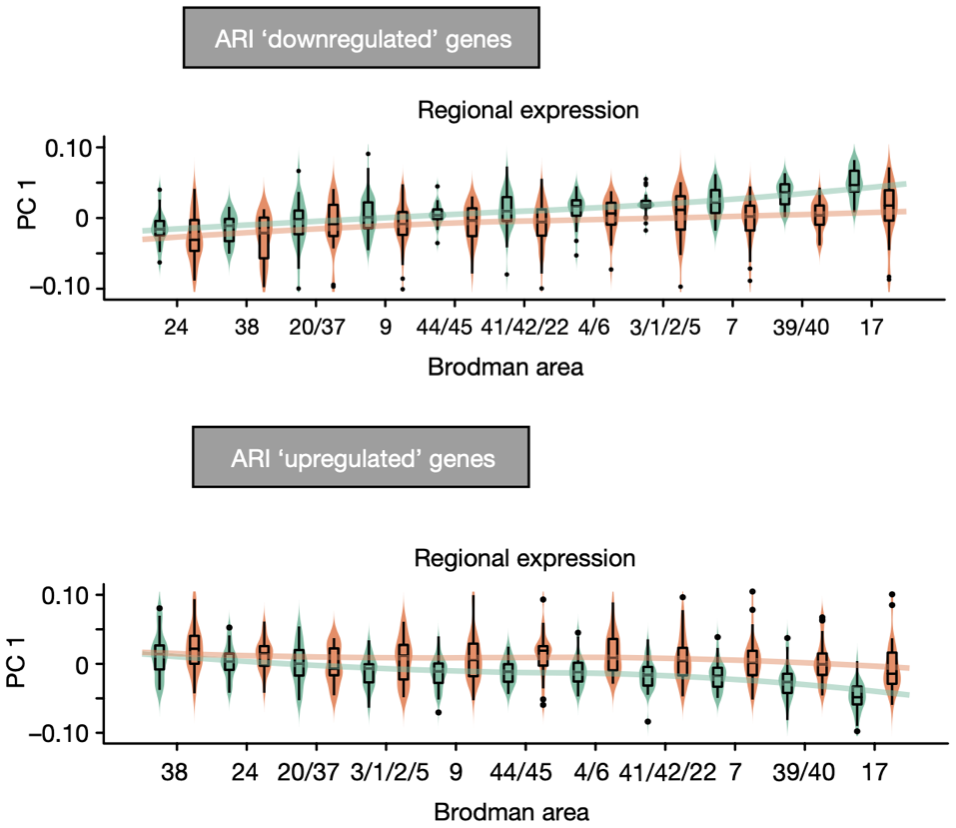
ARI下调(上图)和上调(下图)基因在皮层靠后区域中ASD患者样本(橙色)相对于正常人样本(绿色)的变化更大
这表明原本存在于大脑皮层中从前到后的基因表达梯度,在ASD患者的皮层中衰减消失了。
接着,为了识别在ASD患者大脑皮层中出现协同变化的基因模块,Geschwind团队对所有大脑皮层样本的基因表达数据做了基因共表达网络分析(WGCNA),当然分析的基因表达数据还包括可变剪接产生的转录本表达谱。
结果他们在ASD患者样本中一共发现了38个至少在一个皮层区域出现上调或下调协同变化的基因模块。这些模块大部分可分为两类:(1)在所有皮层区域中都有较为一致的协同变化的基因模块为18个;(2)在不同的皮层区域协同变化有较大差异的基因模块为13个。
在第一类基因模块中有两个模块——GeneM5(基因模块)和IsoformM37(转录本模块)还显著富集了ASD相关的常见遗传变异。GeneM5在ASD中下调,其中包括许多与突触囊泡功能和细胞骨架,以及突触可塑性相关的基因,甚至还显著富集了一些会发生与ASD相关的罕见的功能破坏性遗传变异的基因,例如GRINA、MYO5A以及BTRC。IsoformM37则在ASD中上调,其中包括与热休克反应和蛋白质折叠相关的基因。
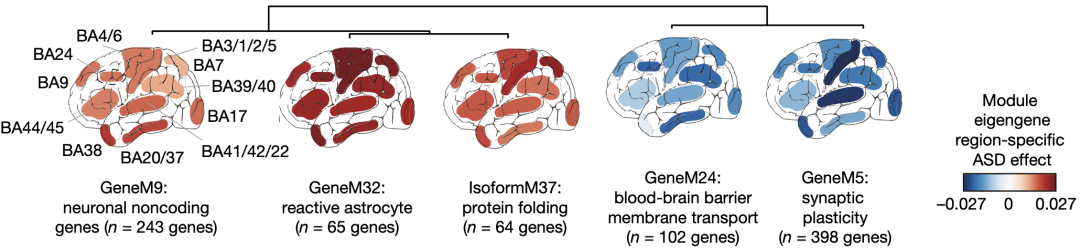
在ASD患者大脑皮层各个区域协同变化一致性较高的基因模块
第二类基因模块中,没有任何一个基因模块富集已知的ASD相关遗传变异。但是其中有12个基因模块显著富集前面提到的ARI基因,表明这些基因模块在正常人大脑皮层中应该代表着各个区域的转录组特性,而在ASD中这种特性消失了。
12个基因模块中有6个在正常人大脑皮层中靠后区域高表达(相对于靠前区域),但在ASD患者大脑皮层中则出现了下调,有4个则是在正常人大脑皮层中靠前区域高表达,但在ASD患者大脑皮层中出现了上调。
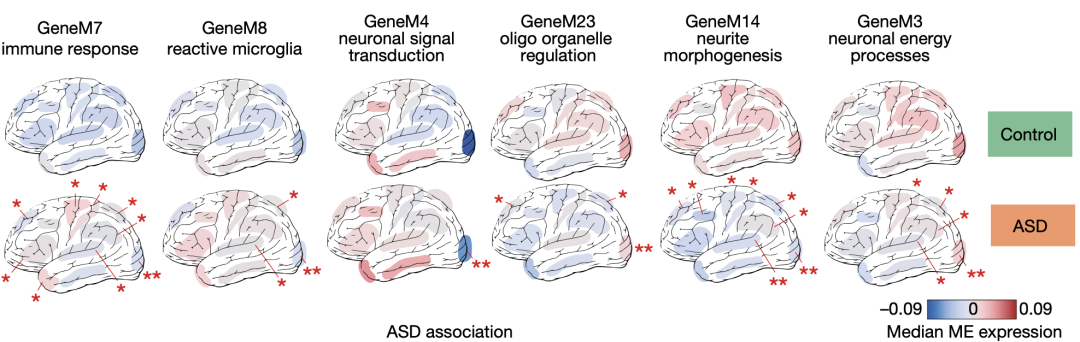
在ASD患者大脑皮层各个区域协同变化并不一致的基因模块
这些结果再一次表明,ASD患者大脑皮层靠后区域中发生了远比靠前区域严重的转录失调,从而导致了ARI。
结合以往的报道,Geschwind和他的同事推断产生这种现象的原因可能是:大脑皮层靠后区域例如BA17相比于皮层其他区域是神经元最密集的区域,在小鼠和灵长类动物的大脑皮层中观察到神经元密度也有从前到后增加的梯度。因此由ASD带来的转录失调严重性与皮层区域中神经元密度有关。
他们还通过分析ASD患者大脑皮层中转录组的变化,和以往报道的灵长类动物皮层各个区域的神经元密度数据的关联性证实了上述推断。
Geschwind团队推测,ASD相关的基因转录的大范围失调,很有可能反映了皮层中各种细胞比例的变化。那么真相究竟是否如此呢?
为搞清楚上述问题,他们对来自6个有明显基因差异表达特征的ASD患者,和6个匹配的正常人大脑皮层的250000个细胞核进行了单核RNA测序,这些细胞涵盖了额叶、顶叶和枕叶皮层。通过对snRNA-seq数据的聚类,他们识别到了26种不同的细胞类群,这基本上代表了所有在大脑皮层中出现的细胞类型。
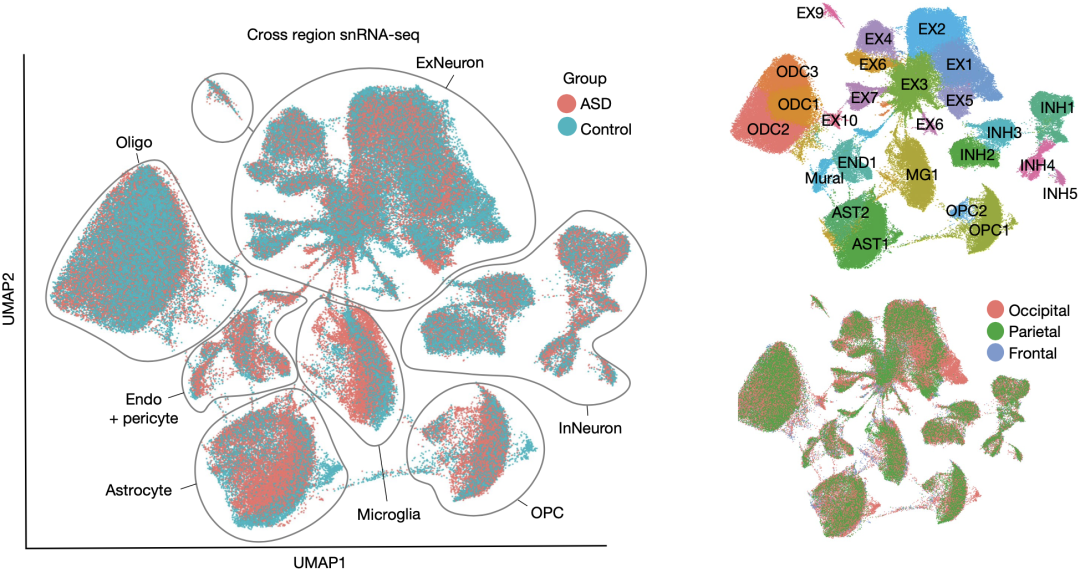
snRNA-seq聚类得到26种细胞类型
接着,Geschwind团队比较了ASD患者和正常人大脑皮层中26种细胞类型的比例,没有发现在FDR校正后仍然显著的细胞比例变化,只有星形胶质细胞比例在ASD患者样本中出现了微弱的上升(FDR>0.18)。
他们还利用之前获得的包含72个个体(ASD患者和正常人各36个)的bulk-seq的甲基化谱做了细胞类型分解,比较之后同样没有发现显著的细胞比例变化。
Geschwind团队还考虑了在前面差异基因计算中加入皮层细胞比例,作为协变量来分析细胞比例对差异基因的影响,结果发现细胞比例加入前后基因差异效应log2FC高度相关(ρ>0.7),这些结果表明细胞比例的变化并不能解释在ASD患者大脑皮层中广泛存在的转录失调。
他们推测前面发现的ASD相关的转录失调,有可能反映了细胞类型特异的基因表达变化,于是他们对在snRNA-seq中发现的26中细胞类型分别计算了细胞特异差异表达基因。结果他们再次观察到了皮层的梯度变化——从前到后差异基因越来越多。其中兴奋性神经元拥有最多的差异基因,并且在枕叶中的兴奋性神经元更为显著。
在研究的最后,Geschwind团队还观察到前面基因共表达网络分析发现的96个基因和转录本模块中,有90个都显著富集了细胞特异差异基因。
上述结果表明,细胞类型特异的基因差异表达很大程度上导致了ASD患者大脑皮层中广泛存在的转录失调,而细胞类型比例的变化带来的影响很小。
总的来讲,这项研究通过一个更大规模的涵盖ASD患者大脑皮层四个小叶的样本队列,证明了转录失调在ASD患者大脑皮层中广泛存在,并且靠后区域的转录失调比靠前区域严重,而这种广泛的转录失调背后是皮层中细胞类型特异的基因转录失调。
参考文献:
[1] Sullivan PF, Geschwind DH. Defining the Genetic, Genomic, Cellular, and Diagnostic Architectures of Psychiatric Disorders. Cell. 2019;177(1):162-183. doi:10.1016/j.cell.2019.01.015
[2] de la Torre-Ubieta L, Won H, Stein JL, Geschwind DH. Advancing the understanding of autism disease mechanisms through genetics. Nat Med. 2016;22(4):345-361. doi:10.1038/nm.4071
[3] Gandal MJ, Zhang P, Hadjimichael E, et al. Transcriptome-wide isoform-level dysregulation in ASD, schizophrenia, and bipolar disorder. Science. 2018;362(6420):eaat8127. doi:10.1126/science.aat8127
[4] Wu YE, Parikshak NN, Belgard TG, Geschwind DH. Genome-wide, integrative analysis implicates microRNA dysregulation in autism spectrum disorder. Nat Neurosci. 2016;19(11):1463-1476. doi:10.1038/nn.4373
[5] Gandal MJ, Haney JR, Wamsley B, et al. Broad transcriptomic dysregulation occurs across the cerebral cortex in ASD. Nature. 2022;611(7936):532-539. doi:10.1038/s41586-022-05377-7
[6]https://www.uclahealth.org/news/brain-changes-autism-are-far-more-sweeping-previously-known
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


