这一国人的发现改写了教科书!cell子刊:线粒体竟有第14个基因编码蛋白质,其在调节哺乳动物早期发育及生育能力方面发挥关键作用
来源:生物谷原创 2024-10-25 09:27
本研究不仅揭示了一种全新的线粒体基因表达调控机制,而且强调了CYTB-187AA这一新发现蛋白质通过与SLC25A3的相互作用,在调节哺乳动物早期发育及女性生育能力方面所发挥的关键作用。
线粒体一直被誉为细胞的“能量工厂”,因为它能够通过氧化磷酸化过程将食物中的营养物质转化为ATP,为细胞提供能量。线粒体不仅参与细胞呼吸、调节代谢,还在细胞凋亡和信号传导中发挥关键作用,对维持生物体正常发育和稳态至关重要。
通常认为,线粒体基因组包含37个基因,其中有13个基因编码蛋白质、22个基因编码转运RNA(tRNA),还有2个基因编码核糖体RNA(12S 和 16S rRNAs)。
然而,最近的一项研究打破了这一传统认知,揭示了线粒体基因的新功能。
一个基因两种蛋白,两种蛋白合成方式
在不久前,中科院广州生物医药与健康研究院刘兴国团队在《细胞·代谢》上发表了题为“A novel protein CYTB-187AA encoded by the mitochondrial gene CYTB modulates mammalian early development”的研究论文,他们发现了线粒体基因CYTB的一个新功能。
CYTB过去一直被认为只负责编码电子传递链中复合体III的一个亚基。但研究发现,CYTB还能编码一个之前未知的、由187个氨基酸组成的蛋白质,研究人员将其命名为CYTB-187AA。

像这种同一个基因能够编码完全不同的两种蛋白质的现象让研究人员倍感意外。
更出乎他们意料的是,这种蛋白质并不是像传统上认为的那样——在线粒体内部合成,而是在细胞质中按照标准的遗传密码翻译出来的,就和细胞里大多数蛋白质一样。研究人员把这种现象称为“细胞质翻译的线粒体蛋白质”(简称mPACT)。
这一发现打破了我们对线粒体基因表达的传统认识,并扩展了线粒体DNA(mtDNA)的功能范围。而与线粒体主要负责给细胞提供能量不同,这种新发现的CYTB-187AA蛋白在哺乳动物早期发育中起到关键作用,特别是它还参与了多能干细胞从一种状态(primed状态)向另一种更原始状态(naive状态)的转变(简称PNT),并对女性的生育力有重要影响。
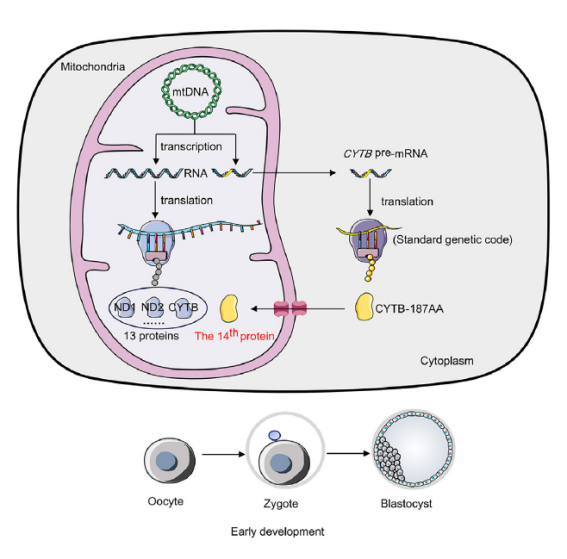
图注:线粒体的第14种蛋白质——CYTB-187AA
CYTB-187AA的发现
1. 生物信息学预测
在本研究中,首先,科学家们通过生物信息学的方法,从庞大的基因数据库中找到了这个蛋白质的“藏宝图”——CYTB基因序列中的一个特定部分,它预示着CYTB-187AA可能由187个“氨基酸积木”搭建而成。就像拼图一样,这些氨基酸积木组合起来,就能形成具有特定功能的蛋白质。他们发现这个序列在多种物种,比如人类和小鼠中都是保守的,说明它可能具有重要的功能。
2. 质谱分析验证
为了验证CYTB-187AA是真实存在的,科学家们又使用了质谱分析的方法,给蛋白质做了一个“指纹鉴定”。他们通过液相色谱串联质谱(LC-MS/MS)技术,识别出了重组CYTB-187AA的特征肽段,并且在人类和小鼠细胞中都检测到了这些肽段的存在,从而确认了CYTB-187AA的内源性表达。
3. 单克隆抗体确认
接下来,科学家们又发明了一种特殊的“钥匙”——单克隆抗体,这把钥匙能准确无误地打开CYTB-187AA这把“锁”。通过这个“钥匙”,他们不仅确认了CYTB-187AA的独特性,还让他们能够在各种细胞类型中检测到它的表达,尤其是在诱导多能干细胞(iPSCs)中,CYTB-187AA的表达量比其他细胞类型更高。
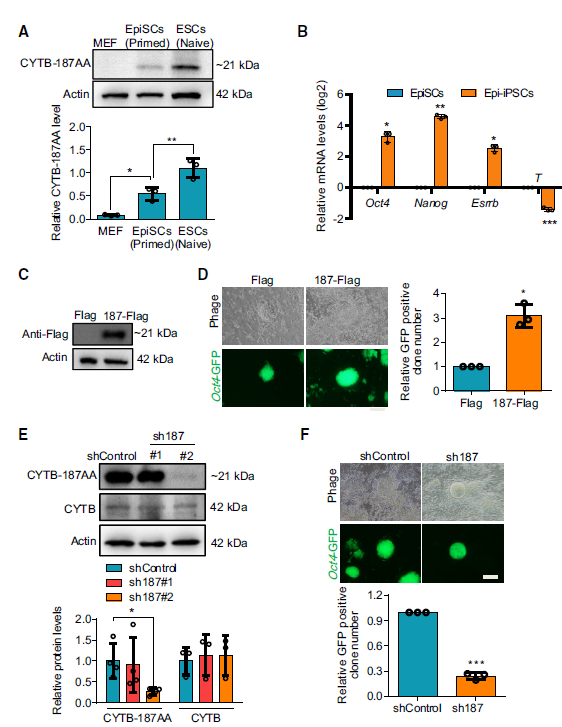
图注:CYTB-187AA促进了PNT
CYTB-187AA来自于哪里?
接下来,科学家们还解开了CYTB-187AA的“身世之谜”。他们发现,这个蛋白质是从线粒体DNA(mtDNA)这个“家族遗产”中继承来的,而不是从细胞核里的“假冒亲戚”——核线粒体假基因(NUMTs)那里来的。
具体来说,他们比较了野生型细胞和缺乏mtDNA的Rho0细胞中CYTB-187AA的表达,并使用不同的抑制剂来处理细胞,观察到了CYTB-187AA表达的变化,从而支持了其线粒体起源的假设。打个比方,这就像是你发现你的家族秘密其实是来自你妈妈的家族,而不是你爸爸的某个远房亲戚。
在确定了CYTB-187AA的存在和来源后,科学家们开始研究它在细胞中的位置。他们利用共聚焦显微镜和截断突变体的方法,发现了CYTB-187AA主要定位于线粒体,并且确定了其线粒体定位的最小序列。通过超分辨率显微镜(SIM),他们进一步确认了CYTB-187AA位于线粒体基质内。
在生殖、发育中的重要作用
科学家们接下来还探索了CYTB-187AA在细胞分化过程中的作用。他们发现,在小鼠的胚胎干细胞(ESCs)和胚外干细胞(EpiSCs)中,CYTB-187AA就像是一个“催化剂”,能帮助干细胞更高效地从一个状态“变身”到另一个状态,这个过程叫做“Primed-to-Naive”转变(PNT)。
他们比较了小鼠胚胎干细胞(ESCs)和胚外干细胞(EpiSCs)中CYTB-187AA的表达,发现ESCs中的表达更高。通过过表达和敲低实验,研究人员确认了CYTB-187AA在促进PNT效率方面发挥着重要作用。
CYTB-187AA就像生物体内一位精细的“能量调控师”,与线粒体中的另一种蛋白质——磷酸转运体SLC25A3协同作业,对机体的能量生成与调控机制发挥着至关重要的作用。通过“共免疫沉淀”(Co-IP)技术,研究人员逐一甄别出了能与CYTB-187AA相互作用的伙伴,证实SLC25A3为其关键伴侣。
随后,通过“蛋白质印迹分析”(Western Blotting),他们进一步验证了CYTB-187AA与SLC25A3的紧密关联。值得注意的是,两者在胚胎干细胞(ESCs)中的表达量均高于胚外干细胞(EpiSCs),表明CYTB-187AA在细胞发育早期阶段扮演更为关键的角色。
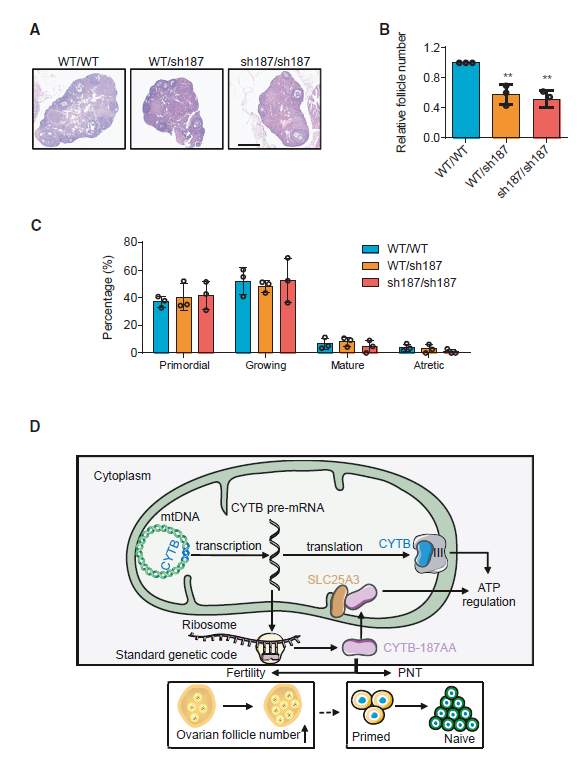
图注:CYTB-187AA敲低减少了卵泡的数量
为了深入探究这一相互作用的功能意义,研究人员实施了基因敲低实验,模拟SLC25A3功能缺失的场景,结果观察到PNT受到抑制,这说明SLC25A3与CYTB-187AA在调控PNT过程中存在功能上的联系。相反,通过过表达SLC25A3,则有效缓解了因CYTB-187AA沉默所导致的PNT抑制,就像为受损的系统注入了修复剂。
此外,研究团队还通过测定细胞内的ATP水平,评估了CYTB-187AA与SLC25A3对能量代谢的影响。结果显示,CYTB-187AA的沉默导致ATP水平下降,而SLC25A3的过表达则能够恢复ATP水平,这进一步证实了两者在能量代谢调控中的协同作用。
最后,在活体研究中,研究人员构建了CYTB-187AA沉默的转基因敲入小鼠模型。该模型展现出雌性生育能力的下降,具体表现为卵巢卵泡数量的减少。这一发现不仅揭示了CYTB-187AA在生物体内功能的实际重要性,也为其在哺乳动物早期发育及女性生育能力调控中的关键作用提供了有力证据。
综上所述,本研究不仅揭示了一种全新的线粒体基因表达调控机制(mPACT),而且强调了CYTB-187AA这一新发现蛋白质通过与SLC25A3的相互作用,在调节哺乳动物早期发育及女性生育能力方面所发挥的不可或缺的作用。这一发现为理解生命活动的复杂调控网络提供了新视角,也为相关疾病的预防与治疗提供了潜在靶点。
参考文献:
Hu Z, Yang L, Zhang M, et al. A novel protein CYTB-187AA encoded by the mitochondrial gene CYTB modulates mammalian early development. Cell Metab. 2024;36(7):1586-1597.e7. doi:10.1016/j.cmet.2024.04.012
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


