CMI | 上海大学陈亮等团队合作发现CD8+T细胞耗竭的调控新机理
来源:生物探索 2024-02-07 17:18
该研究发现Id2通过破坏Tcf3-Tal1转录调节复合物的形成及其对组蛋白赖氨酸去甲基化酶LSD1的募集来抑制免疫逃逸,从而增加了肿瘤CD8+ T细胞衰竭过程中允许的H3K4me2标记的丰度。
上海大学陈亮、空军军医大学朱平及蒋建利共同通讯在Cellular & Molecular Immunology(IF 24)在线发表题为“Id2 epigenetically controls CD8+ T-cell exhaustion by disrupting the assembly of the Tcf3-LSD1 complex”的研究论文,该研究发现Id2通过转录和表观遗传调控Texprog细胞的产生及其向Texterm细胞的转化。Id2基因缺失可抑制CD8+ T细胞介导的免疫应答和干细胞样CD8+ T细胞亚群的维持,抑制PD-1阻断并增加肿瘤易感性。
在机制上,通过其HLH结构域,Id2结合并破坏Tcf3-Tal1转录调控复合体的组装,从而通过阻止Tcf3与组蛋白赖氨酸去甲基化酶LSD1的相互作用来调节Slamf6启动子上的染色质可及性。因此,Id2增加了Slamf6启动子中Tcf3占据的E-box上允许的H3K4me2标记的丰度,调节了Slamf6启动子上的染色质可及性,并从表观遗传学上调控了Slamf6+ Texprog细胞的产生。LSD1抑制剂GSK2879552可以挽救荷瘤小鼠的Id2敲除表型。抑制LSD1可增加肿瘤中Slamf6+Tim-3−Texprog细胞的丰度和Id2缺失的CD8+ T细胞中Tcf1的表达水平。该研究表明,Id2介导的转录和表观遗传修饰驱动分层CD8+ T细胞耗竭,并且获得的机制见解可能对肿瘤免疫逃逸的治疗干预具有指导意义。

T细胞衰竭是慢性病毒感染和癌症期间获得的一种功能障碍状态。在慢性病毒感染期间,耗竭的CD8+ T细胞在层次上失去其功能特性,如细胞因子产生、增殖和细胞溶解能力,伴随着多种抑制受体的上调,这与癌症中观察到的情况相一致。
在慢性病毒感染和癌症中发现了两个耗竭的CD8+ T细胞亚群,每个亚群都具有不同的功能特性和表观遗传景观。祖细胞或干细胞样枯竭的CD8+ T细胞(Texprog细胞)被定义为程序性细胞死亡(PD)-1int、Slamf6+或CXCR5+特征,其特征是多功能细胞因子产生、增殖能力增强、长期存在和转化为最终枯竭细胞的潜力。通过PD-1hi或Tim-3+标记识别的终衰竭T细胞(Texterm cells),尽管其多功能细胞因子的产生、增殖能力和寿命降低,但其细胞溶解能力增强。
抗PD-1治疗可增加Texprog细胞的数量并促进其向Texterm细胞的转化。因此,Texprog亚群可以对免疫检查点阻断(ICB)治疗做出反应,并且比Texterm亚群更有效地抑制肿瘤生长。此外,在对ICB有持久反应的黑色素瘤患者中,Texprog亚群占T细胞的比例更大。因此,增加Texprog亚群比例的方法可能会促进ICB的疗效。然而,CD8+ Tex细胞产生和转化的机制尚不清楚。
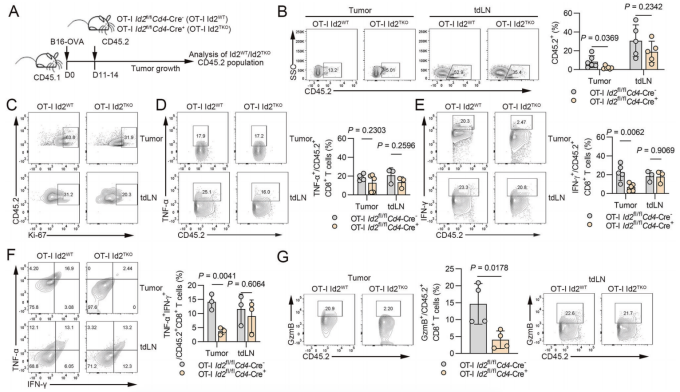
敲除Id2可抑制治疗性CD8+ T细胞的扩增和细胞因子的产生(Credit: Cellular & Molecular Immunology)
转录和表观遗传程序的失调驱动CD8+ Tex细胞的异常抗肿瘤免疫反应。到目前为止,驱动Texprog到Texterm转换的转录和表观遗传途径仍然不明确。此外,作为表观遗传“书写者”或“擦除者”介导CD8+ T细胞功能障碍的特殊染色质修饰酶尚不清楚。因此,在癌症的背景下,研究表观遗传学和免疫学之间复杂的相互作用至关重要。
该研究发现Id2通过破坏Tcf3-Tal1转录调节复合物的形成及其对组蛋白赖氨酸去甲基化酶LSD1的募集来抑制免疫逃逸,从而增加了肿瘤CD8+ T细胞衰竭过程中允许的H3K4me2标记的丰度。该研究表明,Id2介导的转录和表观遗传修饰在分层T细胞衰竭中起着至关重要的作用,并且获得的机制见解可能对肿瘤免疫逃逸的治疗干预具有重要意义。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


