Cell:不孕症研究获重要突破!这种干细胞或成为“试管婴儿”等生育治疗的关键
来源:生物世界 2024-07-04 10:39
该研究发现了一种原本用于辅助胚胎发育的细胞群——原始内胚层,将其分离后单独培养,可以自行生成“胚芽样”的重组胚胎,并揭示了其背后的分子机制。
近日,丹麦哥本哈根大学的研究团队在 Cell 期刊发表了题为:The primitive endoderm supports lineage plasticity to enable regulative development(原始内胚层支持谱系可塑性,使调控发育成为可能)的研究论文。
该研究表明,一种存在于早期胚胎中的能性和再生干细胞——原始内胚层(Primitive Endoderm,PrE),可以在分离后自行产生胚胎,这一突破性发现或将成为治疗人类不孕不育的关键,有助于开发出更成功的“试管婴儿”等生育治疗方式。

早期胚胎中的细胞具有适应和调节其命运以应对扰动的非凡能力,这种特征被称为可塑性,使细胞能够改变其分化轨迹,是发育调控的重要标志。此前的研究发现,在小鼠胚胎中,2细胞阶段的卵裂球在分离后能独自发育成完整个体,但此后随着发育的进行,每个卵裂球的发育潜力逐渐受到限制。
值得一提的是,囊胚的形成伴随着成纤维细胞生长因子和细胞外信号调节激酶(FGF/ERK)介导内细胞团(ICM)细胞向外胚层(Epi)的分化,外胚层产生胚胎本身或胚外原始内胚层(PrE,也称为下胚层),后者随后形成顶胚层(PE)和内脏内胚层(VE)。
在这项最新研究中,研究团队将研究重点聚焦于原始内胚层,这些细胞通常只能为正常胚胎提供营养和支持,属于辅助胚胎生长的“外围细胞”。然而,研究团队惊讶地发现,当他们将来自小鼠胚胎中的原始内胚层的干细胞分离出来并在培养皿中单独培养时,这些细胞以非常高的效率形成“胚芽样”的重组胚胎。
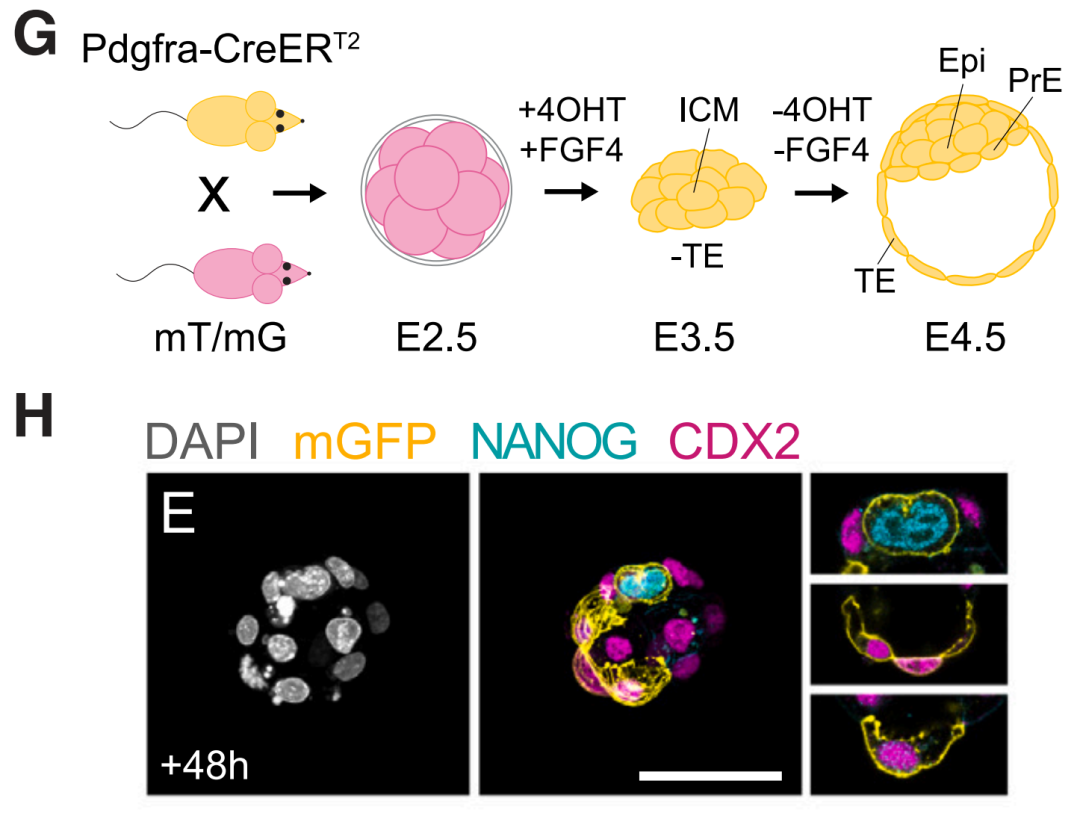
E3.5 PrE在扰动后具有重建胚胎和胚胎外谱系的能力
原始内胚层保持比外胚层更长的可塑性窗口期,并且在正常发育过程中,可以观察到原始内胚层向外胚层转换的细胞命运改变。原始内胚层干细胞来源于初始胚胎干细胞(ESC),可以在LIF、Wnt和TGF-β信号的支持下扩增为初始胚外内胚层(nEnd)。
研究团队使用nEnd在体外重现了这种可塑性,并证明了在nEnd中表达OCT4的细胞群在体外单独培养的情况下有能力形成外胚层(Epi)和滋养外胚层(TE),进而生成一个重组胚胎模型。
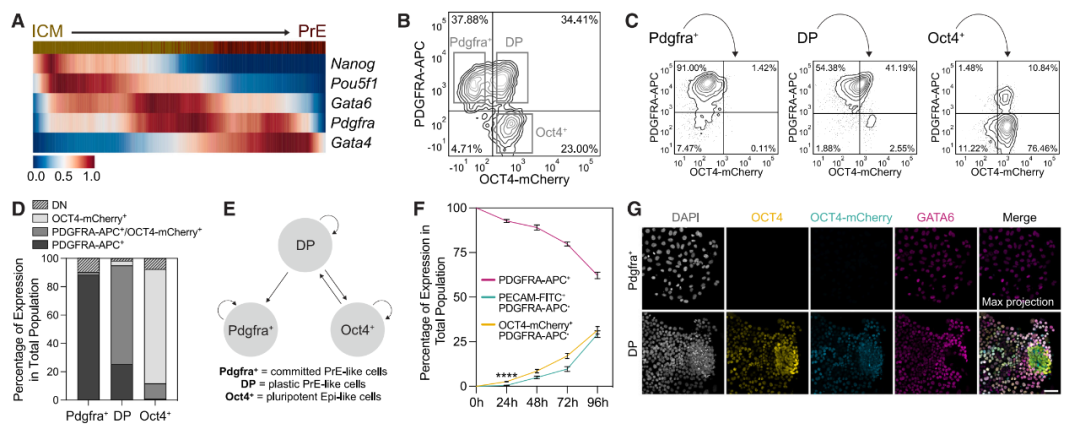
表达OCT4的nEnd细胞群有能力分化成外胚层(Epi)和滋养外胚层(TE)
进一步研究表明,原始内胚层的可塑性由被JAK/STAT信号、OCT4和一组多能性相关转录因子的持续表达所抑制,这些转录因子保护了一个有利于多谱系分化的增强子景观。其中,OCT4是这一过程的关键,这一细胞因子正是著名的诱导iPSC的“山中因子”之一,它不仅可以支持细胞多能性,还处于控制可塑性的基因调控网络的中心。
“山中因子”是由诺奖得主山中伸弥发现的一组转录因子,包括OCT4、SOX2、KIF4和cMyc,这些因子能够诱导细胞重编程为iPSC。
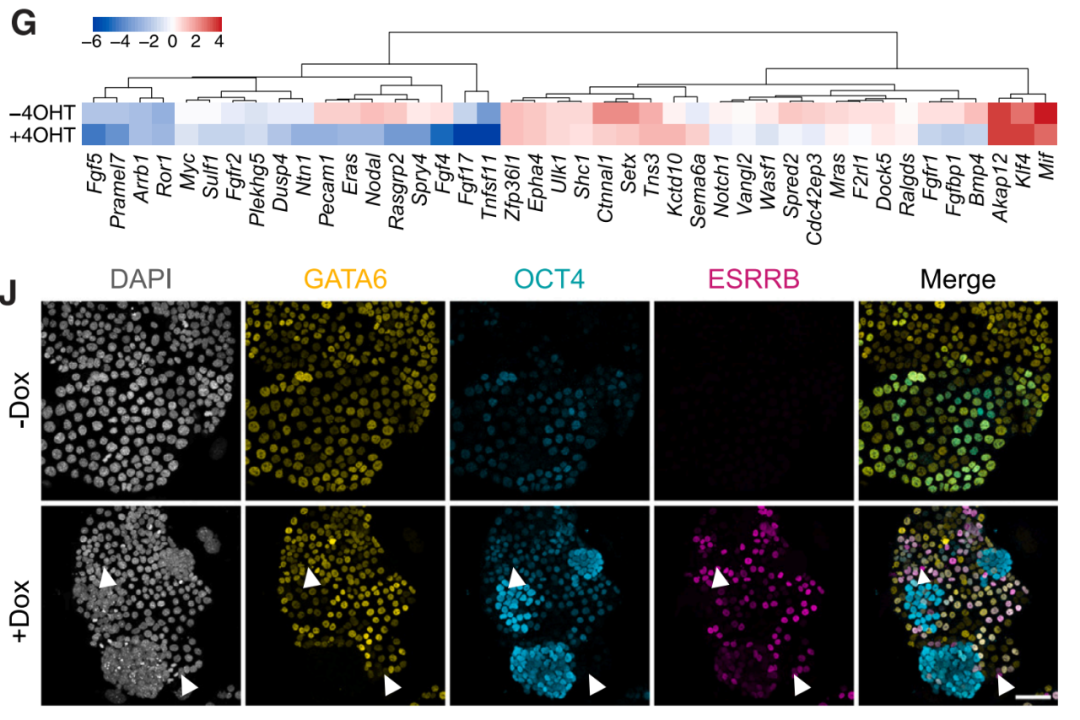
OCT4调控nEnd的可塑性
论文通讯作者 Joshua Brickman 教授表示,囊胚发育的最后一步是形成原始内胚层,原始内胚层会以某种方式“记住”如何创造一个完整的胚胎,如果把原始内胚层分离出来,那么它就会自己生成一个新的胚胎。
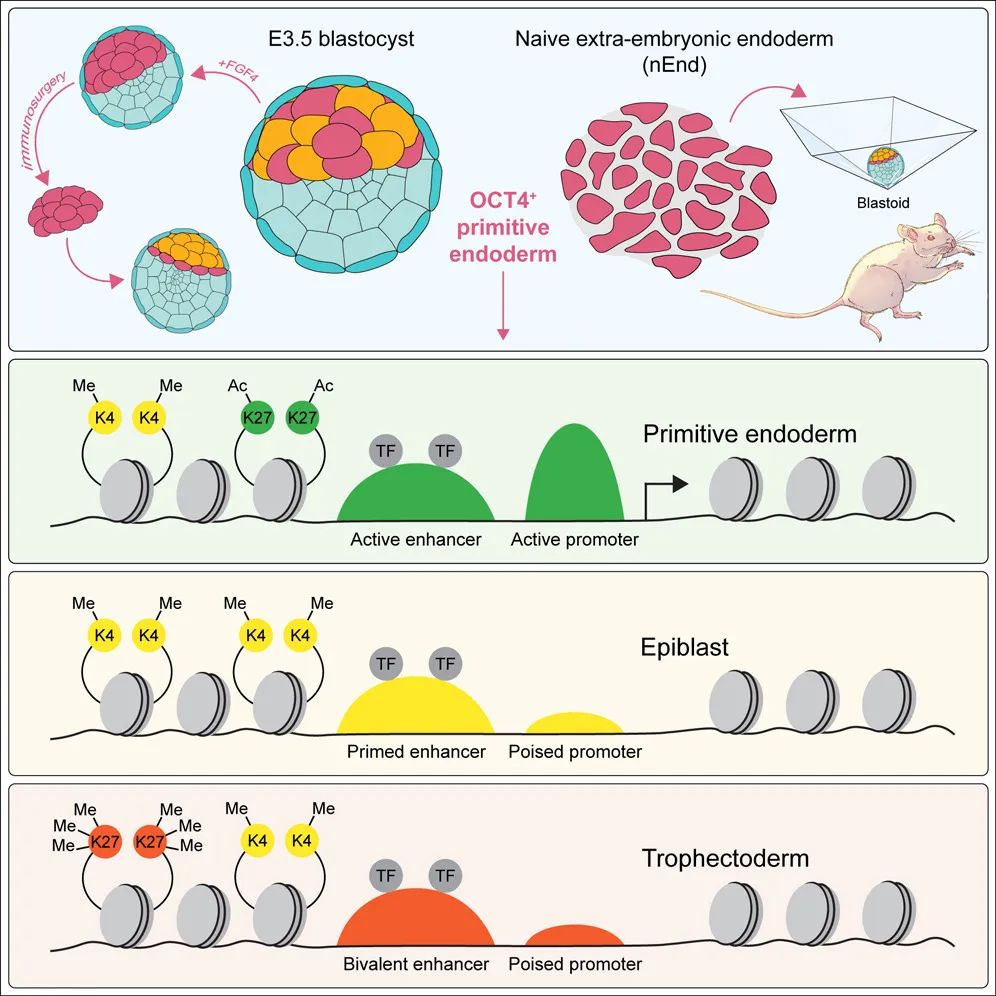
研究模式图
总的来说,该研究发现了一种原本用于辅助胚胎发育的细胞群——原始内胚层,将其分离后单独培养,可以自行生成“胚芽样”的重组胚胎,并揭示了其背后的分子机制。这些发现表明,原始内胚层缺陷可能是导致女性怀孕困难的原因之一,因为它不仅为胚胎发育提供营养支持,还可能在修复发育损伤方面发挥重要作用。这些发现对于改善目前对不孕症的治疗可能特别重要,并启示全新生育疗法的开发,
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


