上海九院开展世界首个基因编辑治疗先天性耳聋临床研究,在mRNA水平修复致病突变并恢复听力
来源:生物世界 2024-04-10 09:30
这项研究也是首次使用单个AAV载体递送RNA编辑工具在临床前研究中实现遗传性耳聋的听力恢复。
日前,上海交通大学医学院附属第九人民医院宣布开展全球首个基于基因编辑的先天性耳聋治疗临床试验。该临床研究由第九人民医院院长吴皓教授牵头,与合作团队共同开发,这是一款基于RNA编辑的新疗法,用于治疗OTOF基因特定突变引起的听力损失。
耳聋是人类最常见的感官障碍,先天性耳聋影响了全世界大约2600万人,其中高达60%的病例是由基因突变引起。
常染色体隐性遗传耳聋9型,是由编码耳畸蛋白(Otoferlin)的OTOF基因突变导致的感音神经性耳聋,占遗传性耳聋的2-8%。耳畸蛋白能使内耳毛细胞响应声音刺激而释放神经递质,激活听觉神经元,当其功能受损时,声音信号将无法被传达到大脑,从而导致感音神经性耳聋,进而严重影响他们的语言、认知和智力发展。
到目前为止,还没有有效的药物能够治疗先天性耳聋。当前的主要方法是植入人工耳蜗。但人工耳蜗存在诸多不足,例如在嘈杂的环境中对语音接受理解受限,且音乐感知能力差。
近年来,基因疗法成功治疗了多种人类但基因遗传疾病。对于OTOF基因突变导致的耳聋,一种基因治疗策略是使用腺相关病毒(AAV)将正确版本的OTOF基因的DNA递送到内耳毛细胞,替代突变基因,进而恢复听力。今年年初,复旦大学眼耳鼻喉科医院的研究团队在《柳叶刀》(The Lancet)发表的一项临床研究也初步验证了这一方法的有效性,帮助5名患儿获得了稳健的听力恢复和语言感知能力改善。
而基因编辑技术,能够直接修复致病基因突变,是一种从根本上治愈遗传疾病的方式,而且,这种治疗方式可能解决基于基因替代疗法潜在的治疗效果随时间推移而下降的问题。此外,RNA编辑疗法是对突变的OTOF基因的mRNA水平的修复,无需永久性改变基因组本身,因此更具安全性。
2023年11月,吴皓教授团队联合辉大基因杨辉研究员等人在 Molecular Therapy 期刊发表了题为:RNA base editing therapy cures hearing loss induced by OTOF gene mutation 的研究论文。

在这项临床前研究中,研究团队使用了杨辉团队开发的基于mini-dCas13X的小型化RNA碱基编辑器——emxABE,使用AAV9突变体进行递送。
由于emxABE小型化的特点,克服了AAV病毒载体递送尺寸的限制,只需单个AAV载体即可递送。此外,与基于CRISPR-Cas9的基因编辑相比,emxABE不会对基因组DNA造成永久性改变,而是对mRNA进行精准的单碱基改变,具有更高的安全性。
在人源化OTOFQ829X/Q829X小鼠出生后0-3天期间通过耳蜗内蜗管注射AAV-emxABE,观察到近乎100%的内耳毛细胞中恢复了OTOF的表达。此外,它们的听觉功能显著改善,达到与野生型小鼠相似的水平,这种听觉功能至少持续了7个月,显示出该疗法具有长期效果。该研究还对出生后5-7天和30天的小鼠进行了治疗,通过内耳圆窗膜注射注射AAV-emxABE,同样有效恢复了听觉功能。
最后,研究团队在野生型小鼠中注射了不同剂量的AAV-emxABE并观察了8个月,它们的听觉功能、动物行为体征,以及血液学、组织病理学均未出现异常,证实了该疗法的安全性。
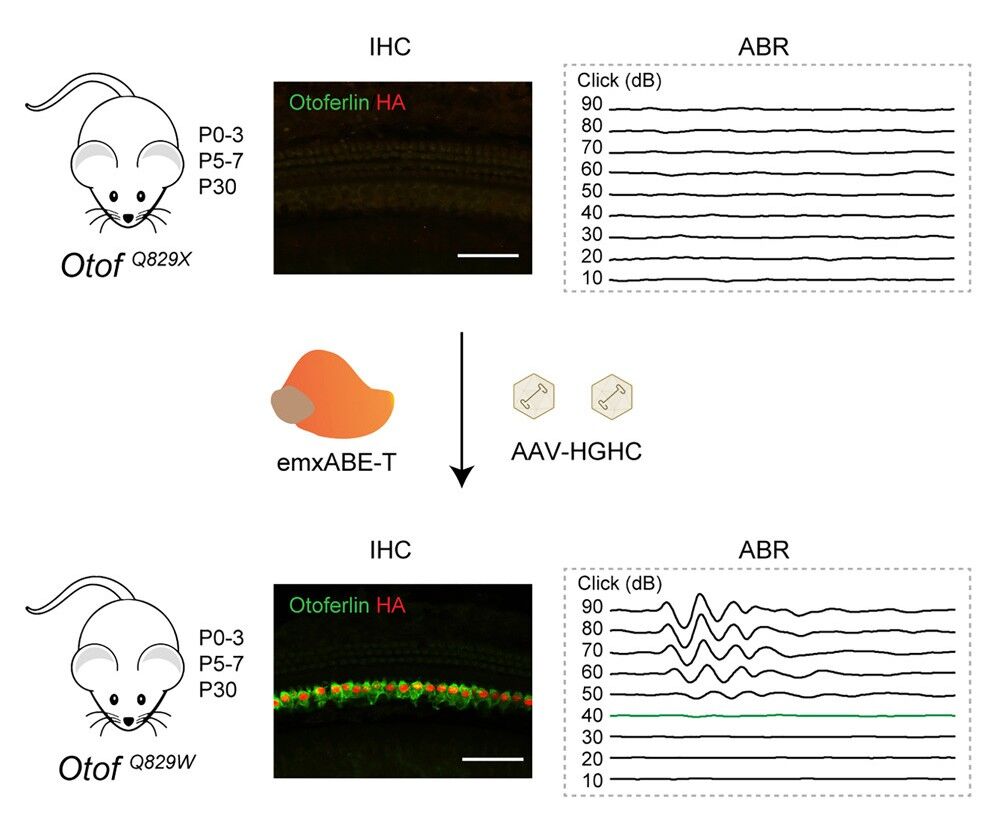
这些结果显示了AAV-emxABE是一种治疗OTOFQ829X引起的听力损失的有潜力的新策。这项研究也是首次使用单个AAV载体递送RNA编辑工具在临床前研究中实现遗传性耳聋的听力恢复。基于这项研究,上海交通大学医学院附属第九人民医院批准开展研究者发起的临床研究(IIT),研究儿童OTOFQ829X突变的先天性耳聋患者单次圆窗内耳给药的安全性及耐受性,目前正在招募受试者。
吴皓教授表示,这种治疗方法已经在动物实验中得到有效性和安全性证实,现在我们正在对具有这种基因突变的患者进行临床试验,可以实现一直注射到内耳来治愈。我们非常有信心,他们有望在治疗后恢复更自然的听力。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


