中国博后一作Nature论文:揭开Cas9的新功能——感知crRNA丰度,守护免疫基因深度
来源:生物世界 2025-09-07 11:08
这一发现不仅修正了对 Cas9 功能的传统理解,也确立了“游离态” apoCas9 在调节 CRISPR 免疫记忆形成中的核心地位,在CRISPR适应性这块,填补了重要空白。
CRISPR-Cas 系统是细菌和古菌中广泛存在的一类获得性免疫机制,其核心功能在于通过“分子记忆”和“精准切割”抵御外源噬菌体和核酸的入侵。该系统由两大关键组成部分构成:一是 CRISPR 阵列,作为免疫记忆库,存储着既往入侵噬菌体、质粒或其他外源核酸的片段(记忆称为 spacer);二是 Cas 蛋白,作为效应分子,负责识别并切割与 spacer 匹配的外源入侵者。典型的单效应核酸酶包括 Cas9、Cas12 以及 Cas13,其系统结构相对简单,分子机制被充分解析,并被开发为突破性的基因编辑、表达调控以及疾病治疗的工具,极大推动了生命科学与医学的发展。
重要的是,Cas9 的已知效应功能均依赖两条小 RNA——crRNA 与 tracrRNA——共同形成靶向复合物;不携带 RNA 的 apoCas9 被认为处于惰性、不具备内源生物学功能。
CRISPR-Cas 介导的免疫过程可分为三个阶段:1)适应阶段(Adaptation),当噬菌体或质粒首次入侵时,Cas1-Cas2 复合物会把外源 DNA 中的特定序列整合到宿主 CRISPR 阵列的前导区(leader)与重复序列之间;2)表达阶段(Expression),CRISPR 阵列被转录为长链 pre-crRNA 后,通过宿主 RNase 酶或 Cas 蛋白加工成成熟的 crRNA;3)干扰阶段(Interference),Cas 蛋白(例如 Cas9)与 guide RNA 组装成效应复合物,其通过 crRNA 的 spacer 序列识别互补的外源 DNA 并启动切割清除。
关于适应阶段,外源核酸前体片段(prespacer)如何由 Cas1–Cas2 复合物整合到 CRISPR 阵列中,成为新的 spacer,已在大肠杆菌的 I-E 型 CRISPR-Cas 中得到深入解析。中国科学院生物物理研究所王艳丽团队报道了 I-E 型 Cas1–Cas2 如何通过 PAM 识别实现 prespacer 的选择(Cell, 2015, 163(4):840-53);加州大学柏克莱分校 Jennifer Doudna教授与耶鲁大学可爱龙教授团队则分别报道了 Cas1–Cas2–prespacer–target DNA 复合物结构 (Nature, 2017, 550(7674):137-14; Science, 2017, 357(6356):1113-1118)。在很多其他 CRISPR-Cas 系统中,spacer 的选择与整合还需要额外因子的协同作用。例如,可爱龙教授团队结构上阐明了 Cas4 如何识别 PAM,并协助 Cas1–Cas2 实现 spacer 的单方向性整合(Nature, 2021, 598(7881):515-520)。对于 CRISPR-Cas9 系统如何产生免疫记忆,细菌分子遗传学揭示了在 II-A 型系统中,Cas9 与 tracrRNA 协同,通过 PAM 识别参与 prespacer 的筛选(Nature, 2015, 519(7542):199-202)。然而,Cas9、tracrRNA 以及 CRISPR RNA 在适应过程中的具体分子机制,目前仍不清楚。
此外,除 II-A 型外,CRISPR-Cas9 系统适应阶段的研究整体仍相对匮乏。多种 Cas9 亚型中,II-C 类接近一半且架构最简单,并被视为比 II-A 更古老的 Cas9 分支。仅保留 cas1、cas2、cas9 和 tracrRNA 基因,而缺乏 csn2、cas4 等辅助因子,其精简的遗传架构提示该系统的适应性免疫阶段的分子机制可能有别于 II-A 亚型,为探索 spacer 获取机制提供重要切入点(Nat Rev Microbiol, 2017, 15(3):169-182)。
2025 年 9 月 3 日,密歇根大学医学院张燕教授和侯仲刚教授领导的研究团队在国际顶尖学术期刊 Nature 上发表了题为:Cas9 senses CRISPR RNA abundance to regulate CRISPR spacer acquisition 的研究论文。
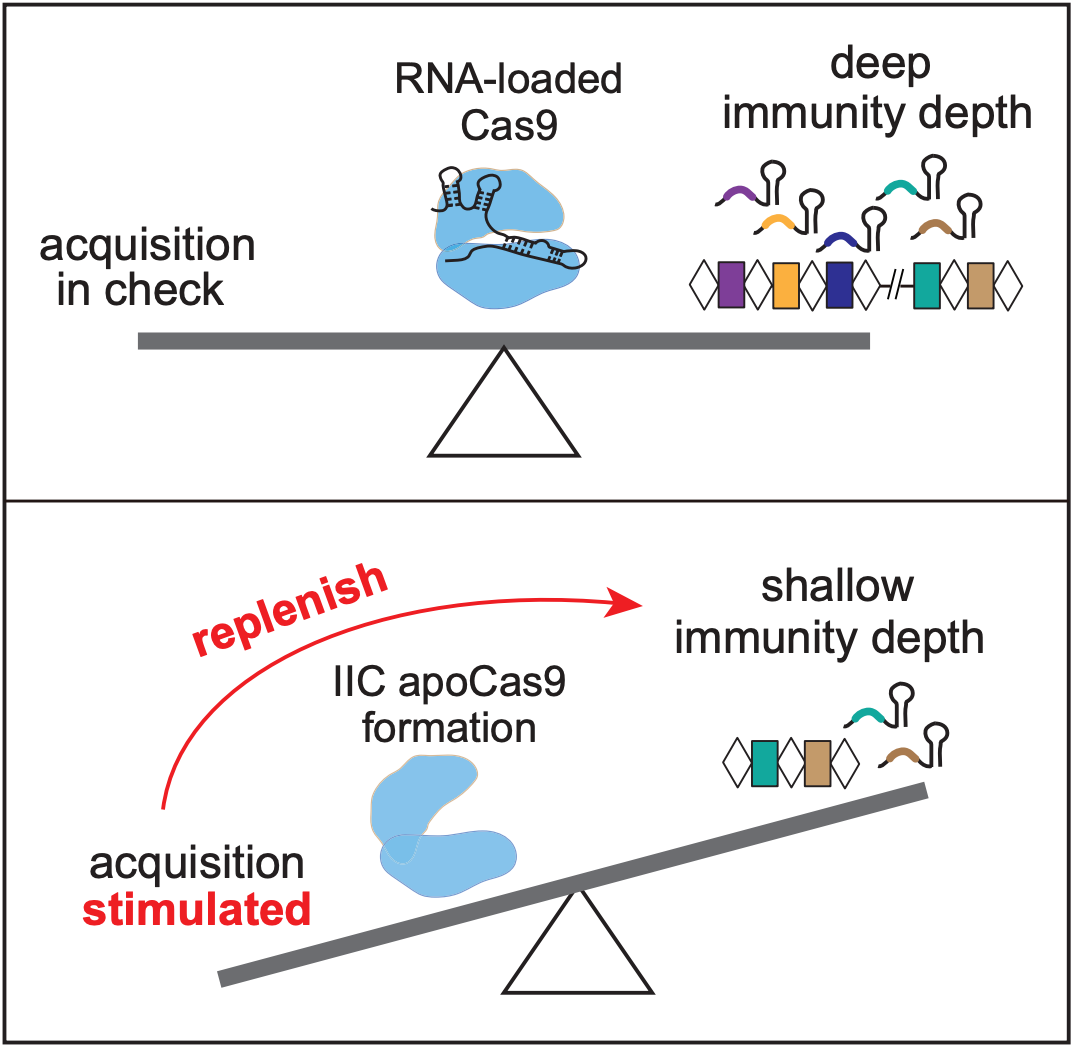
该研究揭示了 II-C 型系统在免疫适应阶段的独特分子调控机制,拓展了对 Cas9 生物学功能的理解:首次发现了 apoCas9(未结合 RNA 状态)在适应阶段能显著提高 spacer 获取效率,推翻了长期以来认为 apoCas9 无功能的传统认知;apoCas9 与 holoCas9(结合 RNA 状态)代表 Cas9 的两种不同分子状态,二者分工明确。apoCas9 促进 spacer 的高效获取,而 holoCas9 主要执行干扰功能;apoCas9 通过感知细胞内 crRNA 丰度,进行自我反馈调节获取 spacer 的效率——Cas9 既是 CRISPR RNA 感应器,又是 spacer 获取效率调节器。
这一发现不仅修正了对 Cas9 功能的传统理解,也确立了“游离态” apoCas9 在调节 CRISPR 免疫记忆形成中的核心地位,在CRISPR适应性这块,填补了重要空白。

该研究由课题组周旭飞博士主导,历时六年,以天然宿主脑膜炎奈瑟菌(Neisseria meningitidis, Nme)为研究对象,借助强有力的分子遗传工具,先后构建上千株突变体,创建了 II-C 型 CRISPR-Cas 的适应性免疫记忆检测体系。在读博士生李鑫则建立了脑膜炎奈瑟菌的天然丝状噬菌体的制备和宿主侵染平台,并完善了通过高通量测序解析免疫记忆的发生特征。周旭飞博士主导将上述平台进行有机整合,并在合作者 Lydia Freddolino 教授实验组的生物信息学支持下,系统性解析了 apoCas9 的全新功能。
当 tracrRNA 或 crRNA 单独缺失,或二者同时缺失时,NmeCas9 处于“apo”游离态,会触发“超级适应”。此时获取新 spacer 的效率较野生型显著大幅提高。进一步的遗传互补实验表明,在双 RNA 同时缺失的背景下,只有同时补回 tracrRNA 和 crRNA,才能完全逆转该表型,而单独补回任一 RNA 组分均不足以恢复。值得注意的是,这一“超级适应”现象的发生既不依赖于 Cas9 的核酸内切酶活性,也并非源于 Cas9 或 Cas1 在蛋白表达水平的变化,而是反映了 apoCas9 的内在调节激活作用。
NmeCas9 由识别叶(REC lobe)和核酸内切酶叶(NUC lobe)两部分构成。REC lobe 包括 REC1、REC2 结构域和桥螺旋(bridge helix),主要负责 RNA 的结合以及 RNA-DNA 杂交体的装载。NUC lobe 包含 RuvC、HNH 切割结构域和 C 端 PAM 识别结构域(WED/PI domain)。通过对 apoCas9 的结构域进行系统性删除分析发现:如果仅保留 NUC 叶,仍能推动“超级适应”来高效促进 spacer 获取,但已失去对 tracrRNA–crRNA 调低的响应。相反,当删除到 NUC 叶内的 RuvC、HNH 或 WED/PI 结构域时,Cas9 则完全丧失驱动“超级获取”的能力。这表明 NUC 叶是驱动 spacer 高效获取的核心因素,而两个 RNA 则通过 REC 叶来约束并从而精准调控 spacer 获取效率。值得注意的是,靶向切割外源核酸时则不同,Cas9 干扰依赖于所有结构域的同时存在。
张燕团队进而一步展示了三类生理情境,揭示 apoCas9 通过感知 crRNA 的丰度,并自我反馈来调节 spacer 获取效率。例如,在 CRISPR array 新生早期进化阶段,长度较短,crRNA 产量低,宿主体内 Cas9 多以“apo” 游离状态存在,促使宿主高效获取记忆,从而帮宿主快速丰富免疫记忆库。随记忆持续积累,CRISPR array 增长,crRNA 丰度也随之升高,Cas9 蛋白逐渐转向 RNA 介导的 “holo” 状态,进而导致 apoCas9 减少,spacer 获取效率下降。由此实现免疫的闭环平衡调节,防止在 CRISPR 够长时维持高水平 spacer 获取,进而产生源于自身 DNA 的自免疫记忆。除此之外,CRISPR array 的稳定性和长度还会受其他自然因素的影响,例如自免疫或者重复序列之间同源重组都可能诱发 array 塌缩和 crRNA 丰度骤降,使 Cas9 变到“apo” 游离状态,短期启动高效的 spacer 获取能力,来维护免疫的深度。
Cas9 守护免疫记忆深度
综上,该研究不仅突破了以往对 apoCas9 “功能空白”的传统认知,还将其确立为免疫记忆深度的“捍卫者”:既作为感应器来感知 crRNA 丰度,又作为效应器在 crRNA 稀缺时促进高效获取免疫记忆,缩短宿主易感窗口期。这一动态调控机制不仅解释了寄主如何在 CRISPR 列阵塌缩后迅速回补,为理解宿主-噬菌体分子博弈提供了新视角,也凸显了 Cas9 主要亚型间适应机制多样性。同时也为未来基于 CRISPR 免疫适应机器的分子记录,谱系追踪,抗噬菌体工程等应用和优化,奠定了理论基础。
张燕博士现任密歇根大学安娜堡分校长聘副教授,医学院 RNA 设计与合成核心平台联合负责人,长期深耕 CRISPR-Cas 领域。以通讯作者在 Nature、Science、Molecular Cell 等期刊发表论文十余篇。她在密歇根大学的团队曾阐明 II-C 型 NmeCas9 靶向 RNA 的分子机理,并聚焦于 apoCas9 在细菌获得性免疫记忆形成和调节中的关键作用。近年也致力于推动 I 型 CRISPR-Cas 基因编辑工具的系统性开发应用,包括建立 Cas3 介导的人细胞大片段基因敲除法,鉴定 I-C 型 CRISPRC-Cas 隐藏的 Cas11 组分,开发迷你 I 型基因敲除和调控工具,并引入 anti-CRISPR 作为可控安全开关。此外,还通过与可爱龙教授团队合作阐明了 Cas3 的活化与抑制的结构基础。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


