Nature:张凯/朱家鹏团队升级原位冷冻电镜技术,成功揭示呼吸链在天然膜环境中的超高清动态结构
来源:生物世界 2024-06-02 10:54
研究方法允许细胞内部微环境下模拟各种病理条件,有望在未来提供关于线粒体内步蛋白复合物的构象状态和详细结构变化更加深刻的见解。
耶鲁大学张凯和南京中医药大学朱家鹏联合研究团队在 Nature 期刊发表了题为:High-resolution in situ structures of mammalian respiratory supercomplexes 的研究论文。
该研究发展了一种极具创新性的原位冷冻电镜技术,直接对心脏来源的完整的线粒体进行透射电子显微成像,首次展现了处于反应态的天然膜环境下的呼吸链复合物多尺度、高动态、超高分辨率原位结构。
这项工作不仅代表了成像技术和线粒体科学研究方面的双重突破,还提供了有关原位膜蛋白研究的未来发展趋势展望,预期将对基础学术研究和临床医学应用均产生深远影响。

成像技术的历史演进是一段数百年的探索旅程,每一次技术创新都带来了学科的进步和科学发现的爆发。冷冻电镜技术,在过去十年中,随着技术的成熟,逐渐已经成为结构生物学领域的主流工具。然而,随之而来有一个更为显眼并且极其重要的问题是:生物分子在细胞环境、特别是膜环境如何工作?细胞环境极其拥挤,成千上万大分子复合物相互作用影响,形成超大相互作用网络,大量复合物在细胞内一闪而过,其相互作用也可能非常微弱。对于膜蛋白,这种情况则更加苛刻。传统膜蛋白结构分析都是基于去污剂纯化或类似方案,这带来的问题是膜蛋白所在的天然膜环境被严重破坏,性质上也相应受到极大影响。特别是一些需保持特殊脂环境、局部膜几何特征、以及膜内外化学环境和电势差等重要因素的彻底丢失,这让去垢剂状态下的膜蛋白结构和性质都无法完美反映天然膜环境的真实情况。
冷冻电镜技术虽然已被广泛应用于呼吸链复合体的研究,但现有的体外成像方法对理解它们在天然环境下的结构和生物学机制存在诸多限制。传统技术主要聚焦于经过纯化的生化样本,对蛋白质的状态和纯度有着严格的要求,这一过程往往导致线粒体天然膜环境的严重丢失,进而导致一系列后续研究瓶颈。
在这项最新的研究中,研究团队跳脱了传统冷冻电子显微镜技术的束缚,完全摒弃了“蛋白质纯化”这个传统概念,直接实现了在完整的细胞器水平上对心脏来源的线粒体进行超高分辨率成像。通过改良及发展成像手段,以及发展新的分析方法,郑婉博士和耶鲁大学在读博士生柴鹏鑫等研究人员从高度拥挤堆叠的、数以千计的不同种类的生物大分子,及成分结构高度复杂的天然生物膜环境直接获取生物大分子结构信息,并获得了近原子层次的超高分辨率原位呼吸链结构。局部结构达到极其惊人的~1.8 Å分辨率,甚至远远超过了纯化后的体外样品通常所能达到的极限。该研究在天然膜环境中精准定位目标蛋白,搭建了呼吸链复合物多种高级组织形态几乎完整的原子模型,并在近原子精度上定量化分析了呼吸链和外周膜环境几何之间的相互影响。研究进一步捕获了大量处于反应态的配体和中间态,清晰又全面地展现了线粒体内部原位状态下的结合水、离子和氢键网络。研究还提出了电子传递过程中偶联质子传递的潜在机制,以空前清晰的方式给出了可能参与此过程的氢键网络系统,并且成功解析了底物状态与复合物构象间的潜在耦合机制。通过模拟不同程度的心脏缺血处理样本,并直接成像对应条件线粒体,该研究还揭示了呼吸链复合物的构象分布与病理状态的关联,为深入探索心脏病、糖尿病、癌症、神经退行性疾病等与呼吸链相关疾病提供了新的研究思路,使得在原位状态下对疾病机理进行原子级别研究成为可能。
系列发现:
1)超高分辨率原位结构: 通过交叉分类结果,确定了类型-A的呼吸超复合物(SC)是最丰富的形式。除了一些柔性区域,在复合物I和复合物III2的大多数区域其分辨率达到1.8-2.4 Å,而在较为多变的复合物IV区域,分辨率也高达2.7 Å。这些高质量的密度图甚至可以清晰地显示了芳香族残基侧链的“孔”、血红素的吡咯环、侧链和铁原子,以及SF4中的S/Fe原子的精确位置。研究人员也成功搭建6327个原位水分子精确位置,包括那些可能在跨膜质子转移过程中起关键作用的水分子。这把原位环境研究膜蛋白的高分辨率结构和机制推向了一个空前的程度,让线粒体里看原子成为可能。
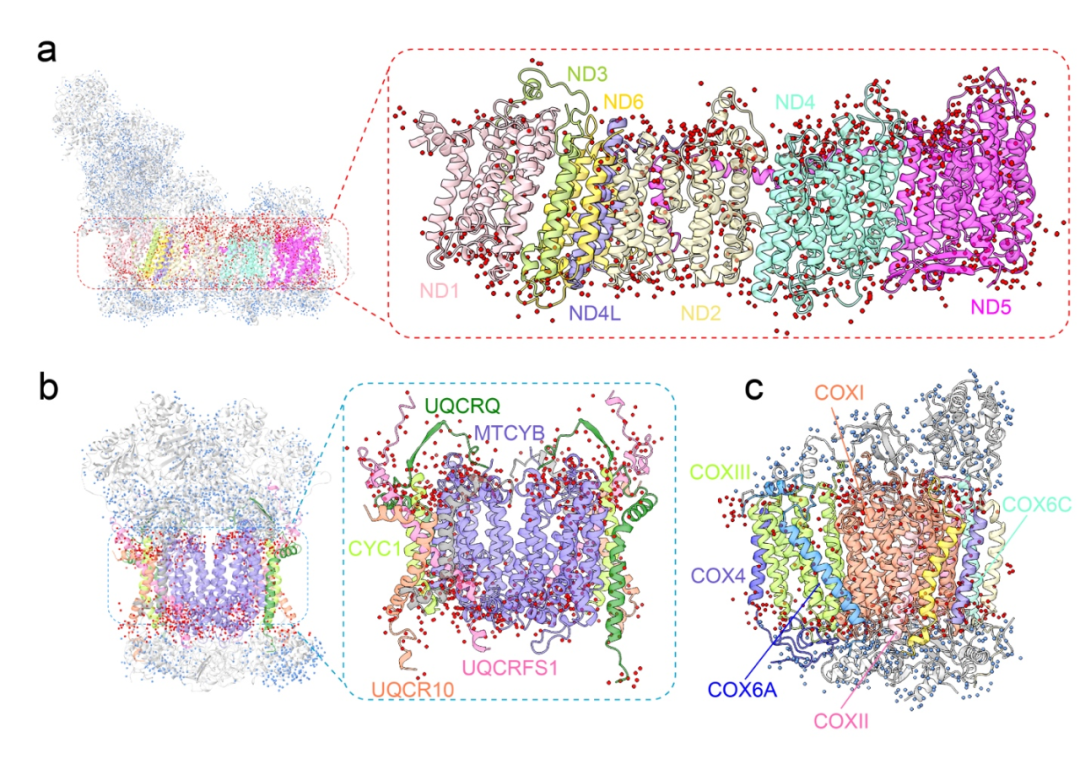
图1:CI、CIII₂和CIV中的水分子。a-c. 结合在CI、CIII₂和CIV中的水分子。蓝点代表亲水区的水分子,红点表示在疏水区附近的水分子。CI、CIII₂和CIV的核心亚基按照图中所示进行颜色编码。
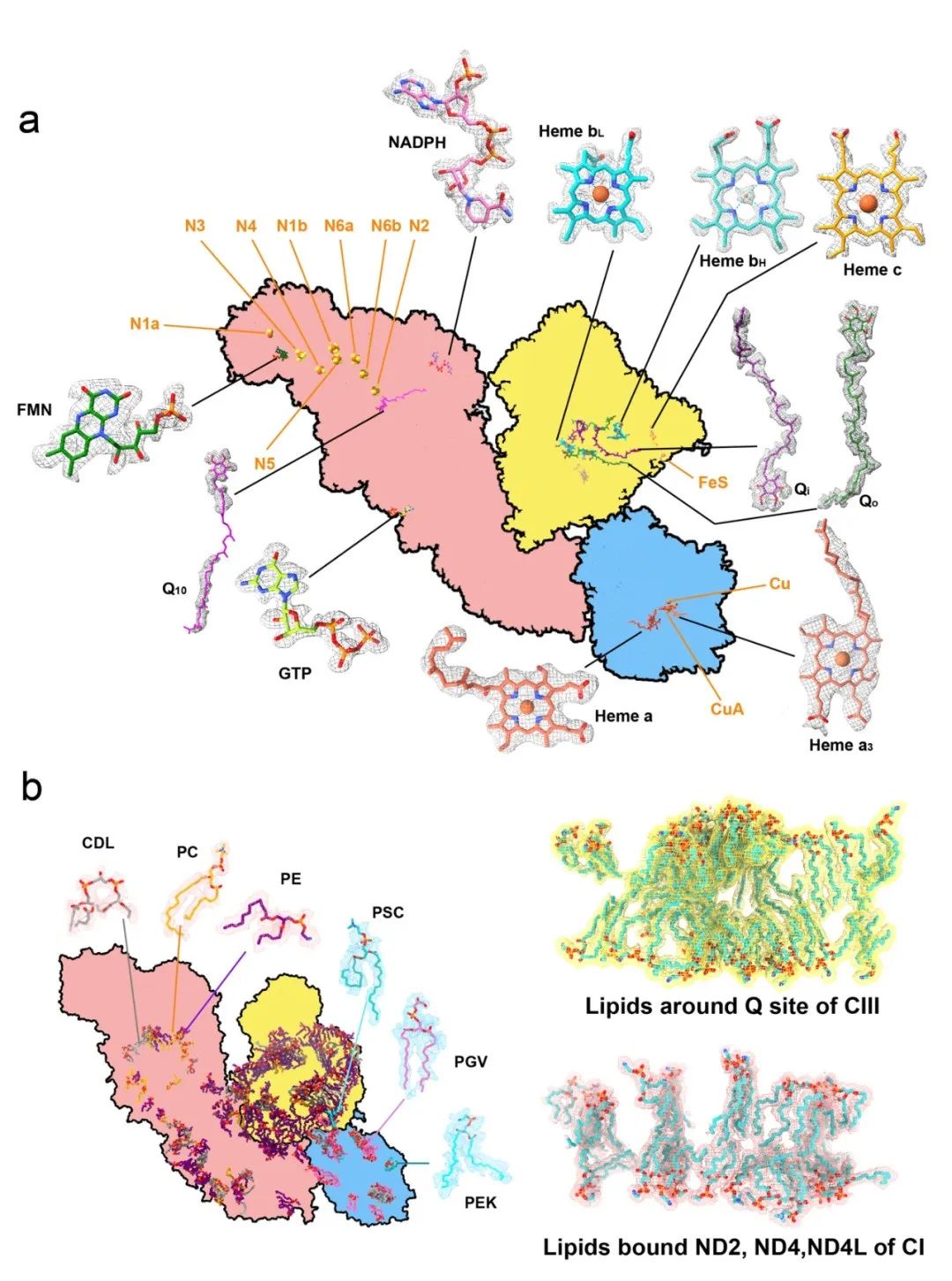
图2:高分辨率原位冷冻电子显微镜结构揭示的内源性辅因子和代表性结构脂质。a. 内源性辅因子的代表性密度图和拟合的原子模型。中心的卡通图表示类型A超级复合体投影的轮廓,并标注了配体位置。b. 从类型A超级复合体的高分辨率冷冻电子显微镜密度图中识别出的结构脂质和相关脂质。
2)四种主要的呼吸超复合物组织形式:研究人员发现原位膜环境存在多种超级复合物组装方式,并将其中丰度最高的几种形式分别命名为,A型(I1III2IV1,经典形式)、B型(I1III2IV2)、O型(I2III2IV2 , Megacomplex)及X型(I2III4IV2)。其中A型为最常见,并且也是在体外纯化的样品中最常获取的类型。O型由清华大学杨茂君教授最早报道并解析结构,过去几年领域有不少观点认为此形式的复合物并不一定存在,而这项原位结构研究用近原子分辨率的确凿证据给这个问题给出了非常肯定的答案:认为O型复合物(Megacomplex)在线粒体内部大量存在。B型和X型为本次研究原位新发现类型。B型为是A型基础上在复合物I和III之间又多出另一个复合物IV。X型因为其顶视图和染色体样子非常相似而得名。这些超复合物展示了不同的复合物组合及其在内膜上的排列方式,揭示了线粒体内呼吸链复合物的多样性和复杂性。并且这些不同类型的复合物潜在地还能形成更高级的组装方式以及以阵列方式排布在线粒体嵴上。
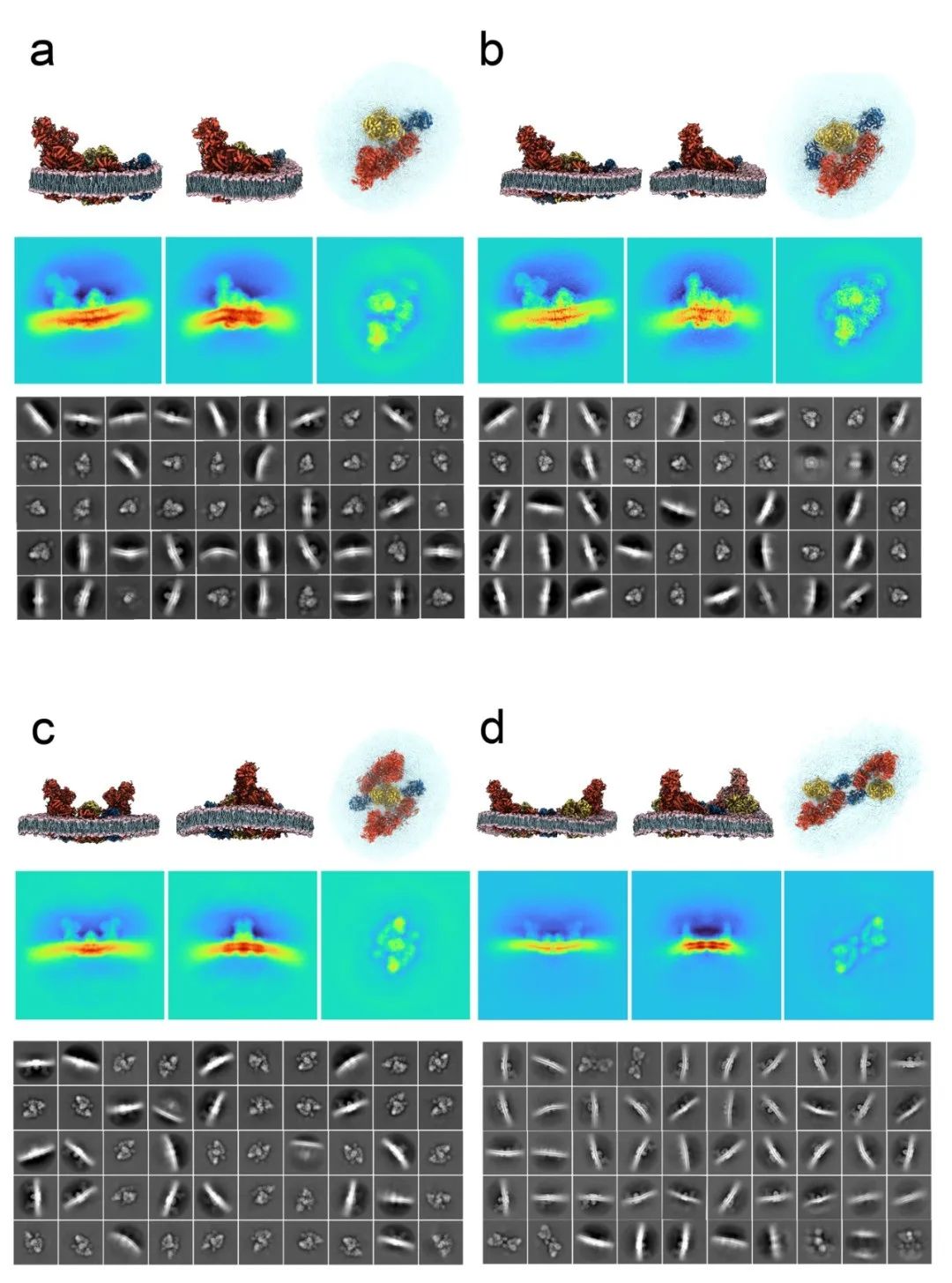
图3 :通过3D精细化后的2D分类评估3D分类结果。a-d. 三种代表性视图中的原子模型(上),相同方向的对应投影(中),以及在3D分类和精细化后类型A(a)、B(b)、O(c)和X(d)超级复合体的代表性无参考2D类平均图。
3)不同超复合物结构和膜几何形状的影响:研究详细探讨了蛋白质和脂质之间的相互作用对超复合物结构和膜几何形状的影响,并发现原位复合物的不同组分之间由“蛋白质-脂质-蛋白质”介导大量的相互作用,这些相互作用不仅决定了超复合物在膜环境中组装方式,还潜在地影响了其功能。研究发现,这些相互作用在维持膜结构和支持复合物功能方面起着关键作用,强调了脂质在线粒体功能中的重要性。研究人员认为,不同组装方式的复合物对局部微环境的膜几何有重要调节作用,这反过来可能影响底物的扩散、呈递和分选。
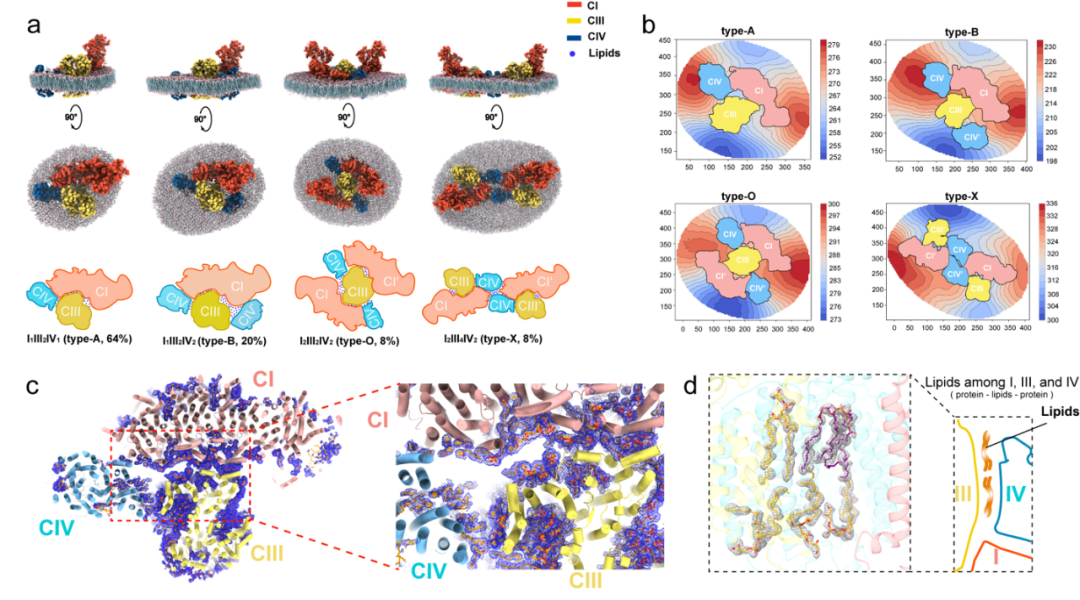
图 4:四种呼吸超级复合体的结构、膜曲率和相互作用界面。a. SCs I₁III₂IV₁、I₁III₂IV₂、I₂III₂IV₂和I₂III₄IV₂的顶部和侧面视图以及卡通模型,其中构建了周围膜的模型。这些视图突显了不同超级复合体组成对局部膜曲率的影响。b. 从线粒体基质侧面观察到的四种主要类型SCs周围本地膜的等高线图。红色和蓝色分别表示高和低海拔。这些梯度清楚地显示了一个共同特征,即CI跟部和CIII₂区域周围的膜分别是凸和凹的。它们还显示了四种类型之间的局部曲率差异。c. 类型A超级复合体中CI(浅红色)、CIII₂(浅黄色)和CIV(浅蓝色)之间的相互作用界面。蓝色网格表示填充在这些复合体之间的脂质分子的密度图。d. 在CIII₂和CIV之间的界面中构建的代表性局部密度图和脂质的原子模型。(4)捕捉反应中间体:研究揭示了复合物I中的辅酶Q/辅酶QH2交换和复合物III中的Q循环过程中一系列中间体的构象,揭示了超复合物内的动态过程。这些发现提供了对电子传递和该过程偶联的质子泵过程的动态信息,揭示了这些复合物在能量生产过程中的关键作用,为理解线粒体能量转换机制提供了新的视角。
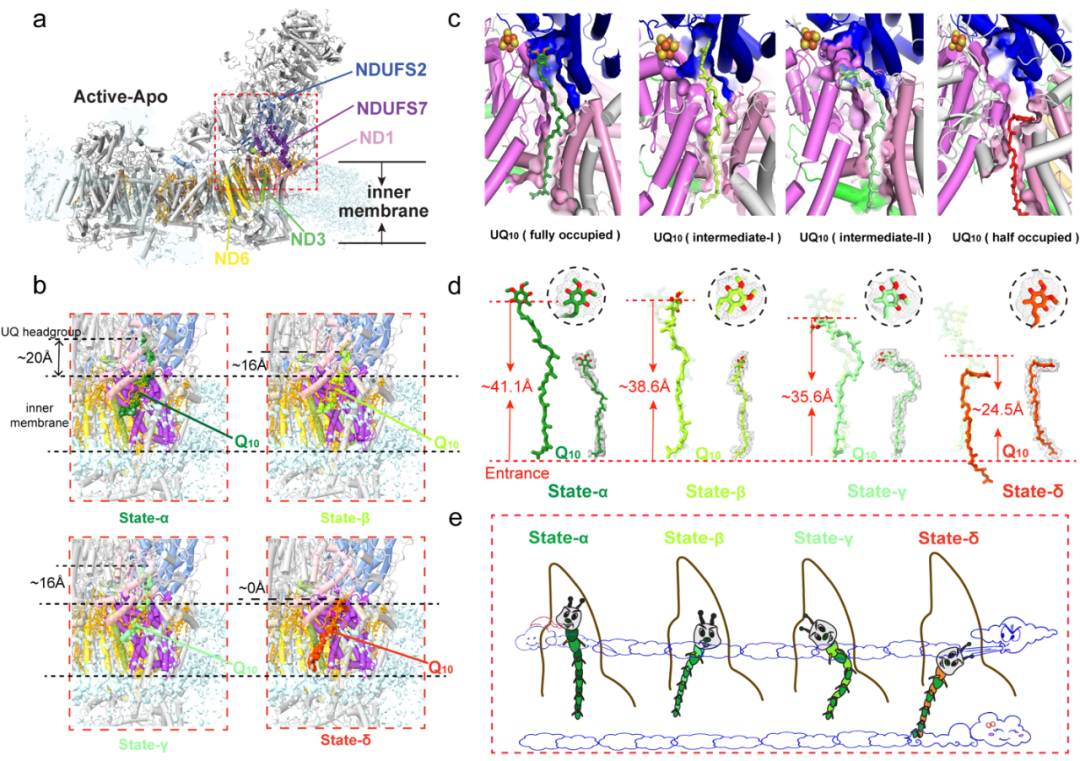
图 5:高分辨率原位结构揭示Q结合通道内的多个Q/QH2结合状态。a. CI活性apo状态的卡通模型,突出显示构成Q结合通道的亚基。b. Q10头基与膜表面之间的距离变化,分别在完全占据、两个中间状态和半占据状态下测量。膜表面的高度是通过CI“跟部”周围脂质头基的平均值估算的。c. 在四种不同结合状态下,Q10在Q结合通道内的空间位置。d. 三种其他结合状态与完全占据的Q10(透明棍状)进行比较。不同结合状态下,Q10头基到醌结合通道入口的距离各不相同。e. Q10在Q结合通道内的蚕丝状波动运动的示意图。
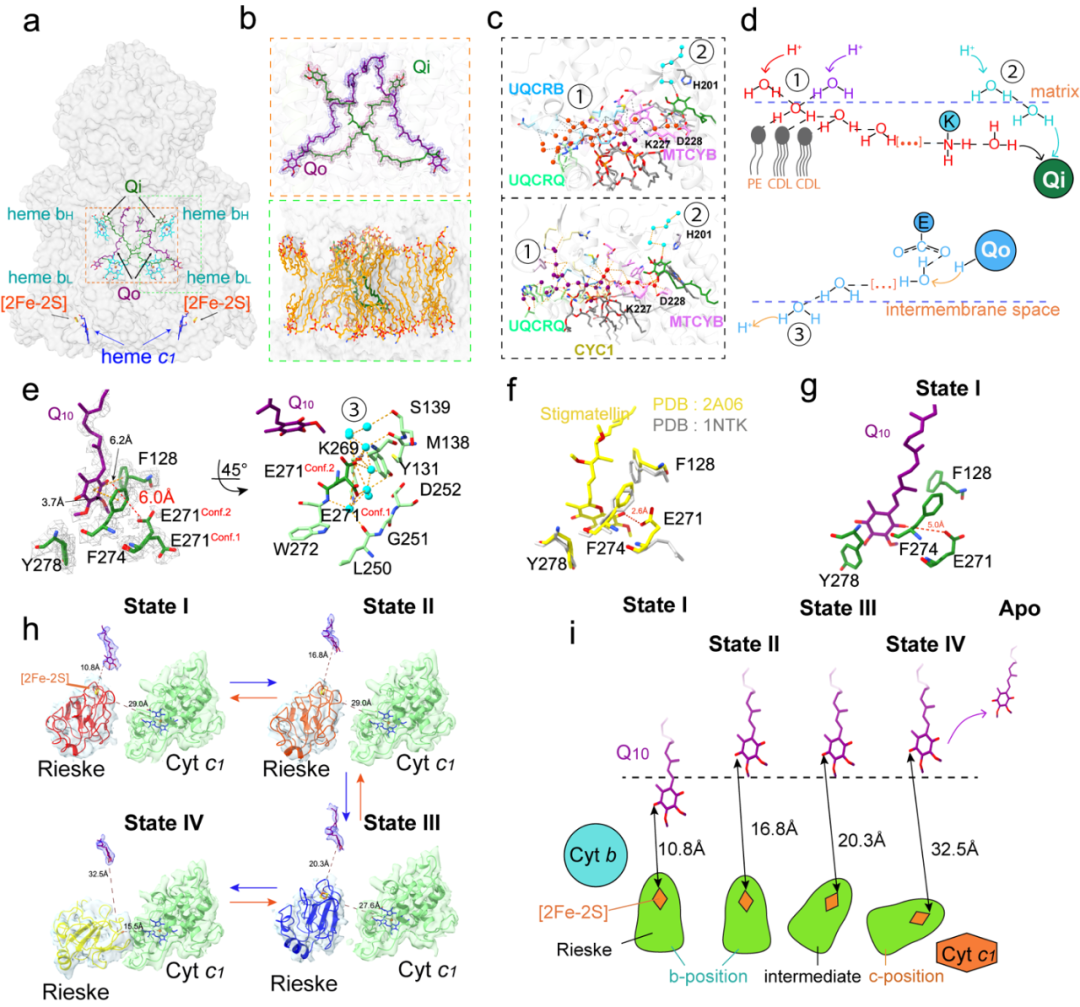
图6 :高分辨率原位冷冻电子显微镜揭示的CIII₂动态中间体。a. 结构解析了所有反应中心。b. CIII₂ Q结合口袋内和口袋入口周围的内源性Q10和脂质分子。这些脂质以相对有序的方式排列。c. 不同视角的氢键网络和用于质子转移的水链。红色和紫色球表示在分叉质子流入路径的两个分支中的水分子,青色球表示在单线质子流入路径中的水分子。d. ①分叉质子流入路径,②单线质子流入路径和③质子流出路径的示意图。e. 最丰富类别中Qo结合位点的结构细节。在该类别中,E271MTCYB显示出双重构象。Q10和氨基酸分别以紫色和绿色表示。蓝色球表示靠近Qo位点的质子流出路径中的水分子。f. 比较apo形式的CIII(PDB: 1NTK)和其与Qo抑制剂stigmatellin复合物(PDB: 2A06)在(e)中相同视角下的E271构象。g. State-I状态下Q结合位点的结构细节,距[2Fe-2S]最近。h. 高分辨率原位结构揭示的CIII四种主要Q结合状态。Rieske依次从b位置移动到c位置以传递电子。这种移动与Qo位点的Q结合状态耦合。Q10头基的密度图显示为蓝色网格,而Rieske结构域和Cyt c1显示为透明表面。i. ISP运动与Q结合状态耦合的示意图。
5)环境对构象变化和配体结合状态的影响:通过在不同环境条件下处理线粒体,研究比较了呼吸链超复合物的构象变化和配体结合状态。结果显示,复合物I和III在不同程度的处理情况下,构象分布发生明显改变,这可能和局部微环境的氧化还原状态变化有关。这些变化潜在揭示了线粒体如何通过调整其结构和功能来响应不同的生理条件,从而维持细胞的能量平衡。
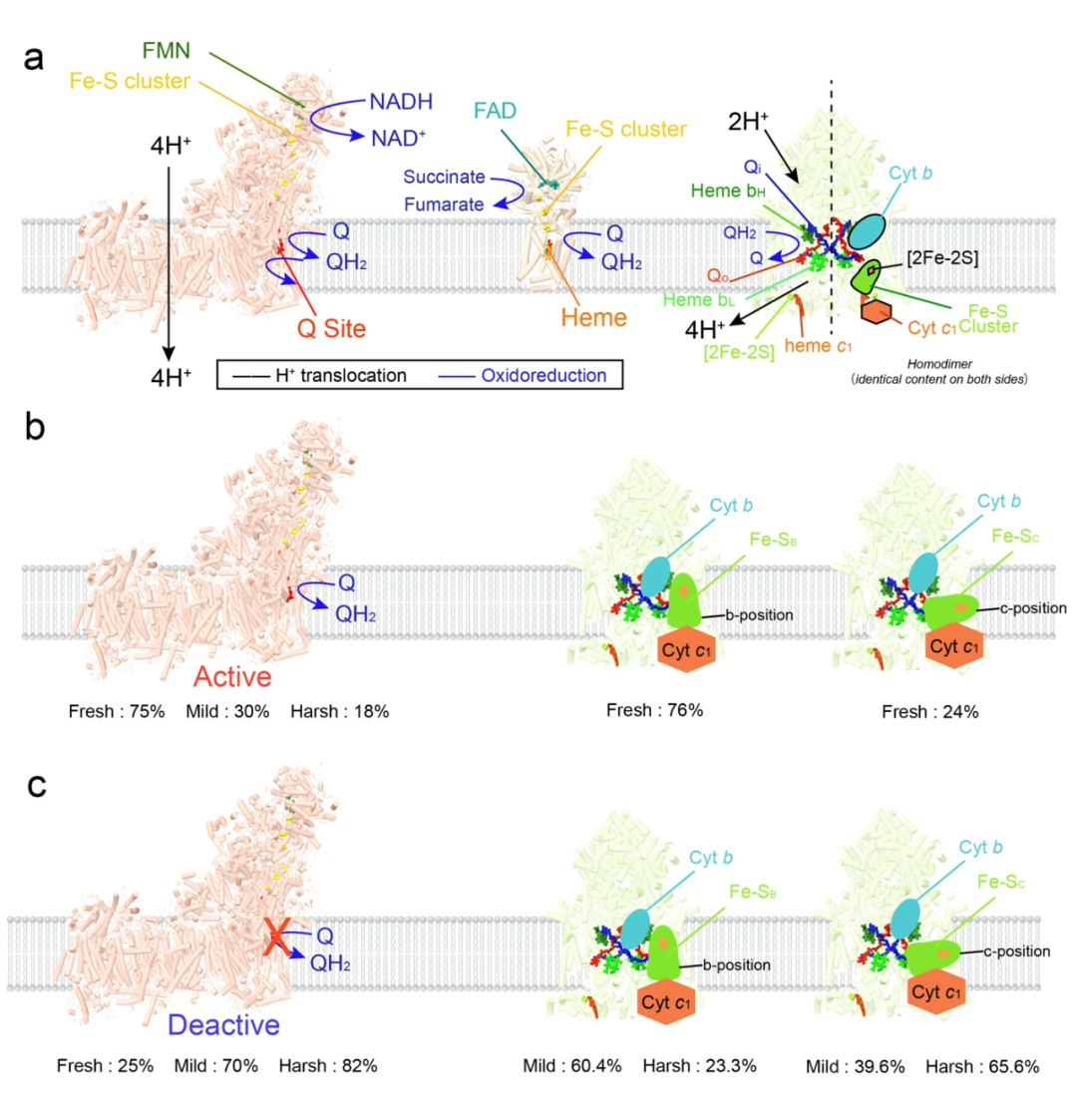
图7 :不同处理条件下CI和CIII构象状态的分布。a. CIII使用来自CI或CII的QH₂作为其底物。b. 在“新鲜”样品中,约75%的SCs中的CI处于活跃状态。这与在不同条件下活跃状态的稳定性形成对比,其中在“温和”和“苛刻”实验条件下,分别只有约30%和18%的CI保持其活跃构型。值得注意的是,在“新鲜”样品中,CI主要处于其活跃状态。同时,CIII中的ISP结构域在b位置(76%)和c位置(24%)之间分布。c. 在“新鲜”样品中,约25%的CI处于失活状态。此比例在实验条件下显著增加,在“温和”条件下约有70%的CI处于失活状态,在“苛刻”条件下进一步上升到82%。同时,CIII中ISP结构域在b位置的分布在“温和”条件下变为60.4%,在“苛刻”条件下降至23.3%。相反,在CIII中c位置的比例在“温和”条件下转变为39.6%,在“苛刻”条件下上升到65.6%。
非常值得一提的是,研究团队本次使用的方法把结构生物学的样品制备方法大大简化,即完全摒弃了“蛋白纯化”这个传统概念,也绕过了冷冻聚焦离子束(cryo-FIB)这个繁琐耗时又昂贵的步骤。相比其它两者,直接成像细胞器,即能把制样过程中导致的对天然膜环境的破坏程度降到最低(相对于去垢剂或离子束处理而言),又能把样本获取过程和制备成本变成真正的“白菜价”,让几乎每一个实验室都能玩得起。该研究方法允许细胞内部微环境下模拟各种病理条件,有望在未来提供关于线粒体内步蛋白复合物的构象状态和详细结构变化更加深刻的见解。这项工作有可能对许多与线粒体相关的疾病的研究思路和治疗策略产生重大影响,包括心脏病、神经退行性条件和癌症等。此外,研究中所涉及的方法可以扩展到大量其他完整的细胞器或细胞亚结构范围的超高分辨率蛋白结构研究,如整个纤毛、叶绿体、高尔基体、溶酶体、甚至轴突等。显而易见地,该突破有望为超高分辨率原子结构细节全面进军细胞生物学开辟一条全新的研究思路。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


