cell子刊:揭示m6A修饰的长链非编码RNA调控神经元的发育及机制
来源:分子细胞卓越中心 2022-12-14 16:26
本研究揭示了神经元发育中lncRNA的m6A动态修饰通过稳定RNA结合蛋白调控mRNA翻译的功能。
近日,Cell Reports在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)鲍岚研究组的最新研究进展(m6A-modified lincRNA Dubr is required for neuronal development by stabilizing YTHDF1/3 and facilitating mRNA translation)。该研究揭示了长链非编码RNA (lncRNA) Dubr的m6A修饰通过稳定YTHDF1/3复合体以及其介导的mRNA翻译从而调控轴突生长和神经元迁移的分子机制。
神经元作为一类高度特化的细胞,具有复杂的树突和轴突。神经元胞体中的mRNA可以运输至树突和轴突,并通过mRNA局部动态翻译合成新蛋白,参与调控神经元发育以及神经网络的建立。前期研究发现,初级感觉神经元轴突中富集microRNAs(miRNAs),同时通过调控轴突中的局部翻译并参与轴突延伸(Wang et al., Cell Reports, 2015;Wang & Bao, Journal of Molecular Cell Biology, 2017)。最近的研究发现,轴突富集的lncRNA ALAE通过竞争RNA结合蛋白 KHSRP并与Gap43 mRNA相互作用,从而调节轴突局部翻译和参与轴突生长(Wei et al., Cell Reports, 2021)。上述研究表明,非编码RNA在神经元的发育中发挥重要调控作用。
RNA甲基化修饰是数百种RNA修饰中普遍和富集的修饰。N6-腺苷酸甲基化(N6-methyladenosine,m6A)是其中丰度最高的动态修饰,参与RNA代谢、剪接、翻译、出核和运输等重要细胞生物学过程。已有研究表明,m6A甲基化修饰在哺乳动物大脑中高度富集,同时在早期神经元分化、生长以及学习记忆等方面均发挥重要作用。尽管最近的研究提示lncRNA调控神经元轴突发育(Wei et al., Cell Reports, 2021),但对这些lncRNA是否存在m6A修饰以及m6A修饰在lncRNA参与神经发育中的功能与作用机制知之甚少。
本研究对小鼠背根神经节(DRG)组织中的m6A-CLIP数据和不同组织发育测序的数据进行整合分析,发现lncRNA Dubr被 m6A高度修饰且在神经系统发育早期高表达。利用小鼠体外DRG组织培养、神经元微流小室分隔培养以及胚胎电转等方法,研究发现敲减Dubr可以阻碍DRG神经元的轴突生长以及导致皮层神经元迁移和轴突投射缺陷,而将Dubr的m6A修饰位点突变后则无法挽回神经元的发育缺陷。进一步,研究显示,Dubr通过m6A修饰位点与m6A阅读蛋白YTHDF1和YTHDF3相互作用,同时敲减Dubr或突变Dubr的m6A位点可以加速YTHDF1和YTHDF3蛋白进入蛋白酶体依赖的降解途径,最终导致蛋白水平显著下降。同时,Dubr、YTHDF1和YTHDF3均能调控与神经元发育相关分子Calmodulin和Tau的mRNA翻译,且Dubr通过m6A甲基化促进YTHDF1/3蛋白复合体的稳定来维持Calmodulin和Tau的mRNA翻译并促进感觉神经元的轴突生长和皮层神经元的正确迁移。
本研究揭示了神经元发育中lncRNA的m6A动态修饰通过稳定RNA结合蛋白调控mRNA翻译的功能。该研究加深了关于非编码RNA上m6A动态修饰功能和机制的认知,并为探究神经系统发育的复杂调控机制提供了新视角。
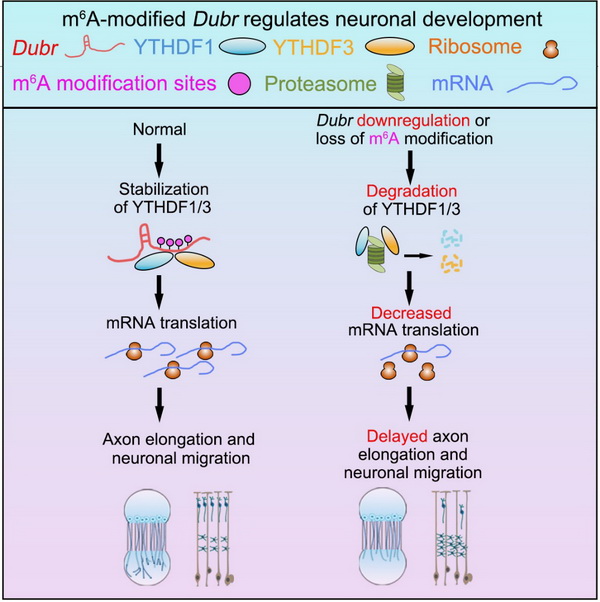
m6A修饰的lncRNA Dubr通过稳定YTHDF1/3复合体和促进mRNA翻译参与调控神经元的发育
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


