免疫疗法+mRNA技术,治疗三阴性乳腺癌并防止复发
来源:生物世界 2022-03-25 11:54
乳腺癌,是女性中最常见的癌症,而在2020年,乳腺癌取代肺癌,已成为全球第一大癌症,WHO国际癌症研究署(IARC)发布的2020年全球最新癌症负担数据显示,2020年全球乳腺癌新发病例高达226万例,死亡68万例。在我国,乳腺癌的发病率也在逐年提升,据WHO预测,2020年中国新增乳腺癌病例高达41万。乳腺癌大多预后良好,但是大约15%的乳腺癌
乳腺癌,是女性中最常见的癌症,而在2020年,乳腺癌取代肺癌,已成为全球第一大癌症,WHO国际癌症研究署(IARC)发布的2020年全球最新癌症负担数据显示,2020年全球乳腺癌新发病例高达226万例,死亡68万例。在我国,乳腺癌的发病率也在逐年提升,据WHO预测,2020年中国新增乳腺癌病例高达41万。
乳腺癌大多预后良好,但是大约15%的乳腺癌为三阴性乳腺癌(TNBC),这类乳腺癌由于雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体-2(HER-2)缺乏而得名,三阴性乳腺癌是最具侵袭性乳腺癌,更容易扩散转移,易复发,而且由于缺少治疗靶点,治疗药物有限,一直是乳腺癌治疗的难点,也被称为“最凶乳腺癌”。
近日,西班牙德尔玛医学研究院的研究人员在 Nature 子刊 Nature Cancer 发表了题为:LCOR mediates interferon-independent tumor immunogenicity and responsiveness to immune-checkpoint blockade in triple-negative breast cancer 的研究论文。
该研究发现,三阴性乳腺肿瘤中的癌症干细胞低表达配体依赖性辅助抑制因子(LCOR),这导致了其对免疫治疗的逃逸。在此基础上,研究团队将 LCOR mRNA 与 PD-L1 抑制剂联合使用,在小鼠模型中完全清除了三阴性乳腺癌细胞,且能够阻止癌症的复发,实现了彻底治愈。
三阴性乳腺癌虽然仅占全部乳腺的15%,但却是进展最快的乳腺癌亚型,而且对年轻患者影响很大。
癌症干细胞(Cancer Stem Cells)是肿瘤中具有自我更新能力并能产生异质性肿瘤细胞的细胞,对癌细胞的存活、增殖、转移及复发有着重要作用。
在使用免疫检查点抑制剂等免疫治疗时,癌症干细胞能够逃避免疫治疗,从而导致对免疫疗法的逃逸和耐药性。这背后的机制是什么呢?
在这项研究中,研究团队发现,三阴性乳腺癌中的癌症干细胞低表达配体依赖性辅助抑制因子(LCOR),导致免疫系统对其“不可见”,也导致临床治疗中,免疫治疗对三阴性乳腺癌效果较差。
研究团队进一步发现,在小鼠模型中激活LCOR基因的表达,能够逆转癌症干细胞的免疫逃逸,让其重新对免疫疗法敏感。
研究团队在三阴性乳腺癌患者的临床样本中进行了验证,发现对免疫检查点抑制剂有应答的患者的LCOR基因表达水平更高。
受到新冠mRNA疫苗的启发,研究团队想通过类似的方式将LCOR基因的mRNA递送到肿瘤细胞中,从而让免疫系统重新识别。
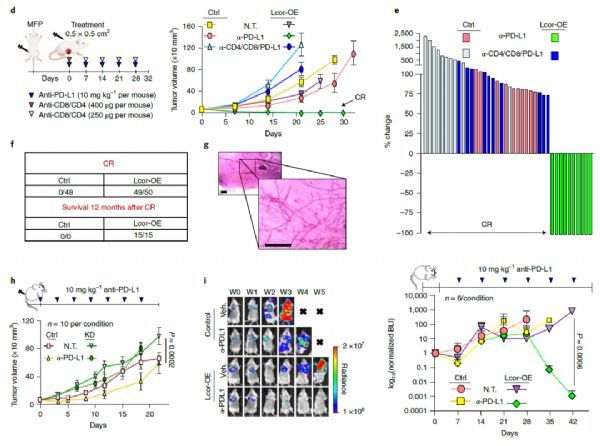
研究团队使用细胞外囊泡递送的LCOR mRNA与PD-L1抑制剂联合使用,治疗三阴性乳腺癌小鼠模型,结果显示,50只被治疗的小鼠中,有49只小鼠的癌症得到了完全缓解,唯一一个没有反应的是因为LCOR的异位表达丢失。在停药后2个月,所有49只完全缓解的小鼠均没有复发肿瘤。
研究团队进一步对其中15只小鼠进行了长达1年的随访,没有1只小鼠出现肿瘤复发,而实验室小鼠的寿命只有1-3年,这说明这种联合疗法能够根除并彻底治愈了这些小鼠体内的肿瘤。
总的来说,该研究发现并证明了 LCOR 基因在调控肿瘤免疫原性和癌细胞对肿瘤免疫疗法反应的重要作用。在三阴性乳腺癌中,癌症干细胞中 LCOR 的表达水平与免疫检查点抑制剂的临床治疗效果有关。该研究进一步表明,通过细胞外囊泡(EV)递送 LCOR mRNA 联合 PD-L1 抑制剂,能够在临床前模型中克服三阴性乳腺癌的耐药性并根除癌细胞、防止癌症复发。这些研究数据支持了 LCOR 基因作为增强三阴性乳腺癌的免疫检查点阻断疗法的有希望的靶点。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。