Nature子刊:高彩霞团队开发大片段DNA精准定点插入新工具PrimeRoot
来源:生物世界 2023-04-25 16:03
研究人员通过工程化结合引导编辑器与位点特异性重组酶,开发了能够在植物中实现10kb以上大片段DNA高效精准定点插入的PrimeRoot系统,该系统将为基于基因堆叠的植物分子育种和植物合成生物学研究提供
基因组编辑技术是生命科学领域的颠覆性技术,为生物学的基础研究和应用研究奠定了坚实的技术基础。历经十余年的不断迭代和迅猛发展,基因组编辑技术经历了如下两个阶段:第一阶段以CRISPR-Cas9技术为代表,利用序列特异性核酸酶良好的靶向性和可编程性,在基因组特定位置产生DNA双链断裂,继而通过细胞内源修复机制产生随机、不可控的小片段插入或删除,达到基因敲除的目的;第二阶段包括碱基编辑技术和引导编辑技术的开发与应用。碱基编辑技术能够在不依赖DNA双链断裂的情况下实现特定碱基的高效精准替换,而引导编辑更是能够精准实现碱基的任意形式突变以及小片段DNA的精准插入或删除,大幅提升了基因组编辑的精准性,极大地拓宽了技术的应用范围。上述技术的叠加使得科学家们能够高效、快速并准确地实现基因敲除、碱基定向突变及少量核苷酸的插入或删除等小片段DNA水平的精准操纵。
随着生物领域研究的快速发展,小片段DNA的编辑已经不能满足研究和应用的需要。新的需求正引领基因组编辑技术突破DNA操纵长度的限制,迈入第三阶段:即实现kb级大片段DNA甚至是染色体水平的精准编辑。然而,目前能够实现大片段DNA精准操纵的基因组编辑工具还十分有限,尤其是在植物研究领域,相关工具还未见报道。
4月24日,中国科学院遗传与发育生物学研究所高彩霞研究组在 Nature Biotechnolgy 期刊发表了题为:Precise integration of large DNA sequences in plant genomes using PrimeRoot editors 的研究论文。
该研究开发了名为:PrimeRoot(Prime editing-mediated Recombination Of Opportune Targets)的新技术,通过系统整合优化的引导编辑(Prime Editing)工具和位点特异性重组酶系统,实现长达11.1kb的大片段DNA的高效精准定点插入。

研究人员首先通过结合该实验室开发的ePPE(Engineered Plant Prime Editor)(Zong et al., Nature Biotechnology, 2022)以及David Liu实验室研发的epegRNA(Engineered pegRNA)(Nelson et al., Nature Biotechnology, 2021)在植物细胞内建立了dual-ePPE系统,实现了最高效率可达50%以上的短片段DNA的精准定点插入,继而使用荧光报告系统在水稻原生质体中评估了分属丝氨酸家族和酪氨酸家族的8种位点特异性重组酶的工作效率,最终将dual-ePPE与筛选出的高效的酪氨酸家族位点特异性重组酶Cre相结合,开发了能够实现大片段DNA精准插入的PrimeRoot系统。
该系统在水稻和玉米中能够实现一步法大片段DNA的精准定点插入,效率可达6%,成功插入的片段长度最长达11.1kb。相比于传统非精准的非同源末端连接(NHEJ)策略,PrimeRoot插入5kb及以上DNA片段的效率有明显提升,且插入完全精准可预测,在编辑效率和精准性上具有显著优势。
该工作中还展示了PrimeRoot介导的大片段DNA精准定点插入的两个具体应用场景:启动子的原位插入是基因功能研究以及新性状创制的重要途经,研究人员利用PrimeRoot在水稻HPPD基因的5'UTR区精准插入了Actin启动子(1.4kb),成功实现了启动子序列在功能基因UTR区域的原位插入;外源功能基因的导入是赋予作物新性状的主要手段之一,而传统基于农杆菌的转基因方式插入位置随机且不精准,往往导致内源功能基因的破坏或外源插入基因表达水平不稳定,使得理想种质的筛选过程繁杂冗长,PrimeRoot大片段DNA精准定点插入为解决这一问题提供了全新方案。研究人员首先通过生物信息学分析预测出了水稻内33个可用于外源基因插入的基因组安全港(Genomic safe harbor,GSH)区域。
全基因组测序分析表明,传统农杆菌介导的T-DNA插入是完全随机不精准的,且无33个GSH内的插入事件。相比之下,PrimeRoot介导的插入能够完全精准定点地落入指定的安全港区域且在全基因组范围内检测不到可预测的脱靶事件。在此基础上,作者使用PrimeRoot将稻瘟病抗性基因pigmR精准插入到预测的GSH内实现了快速抗病育种。
最后,为了进一步提高PrimeRoot的效率,作者在水稻中建立了PrimeRoot组分和插入DNA组分的连续转化体系,该体系下大片段DNA精准插入的效率相较于一次转化提高了2-4倍,插入Actin启动子(1.4kb)的效率达8.3%,插入pigmR基因表达框(4.9kb)的效率达6.3%。
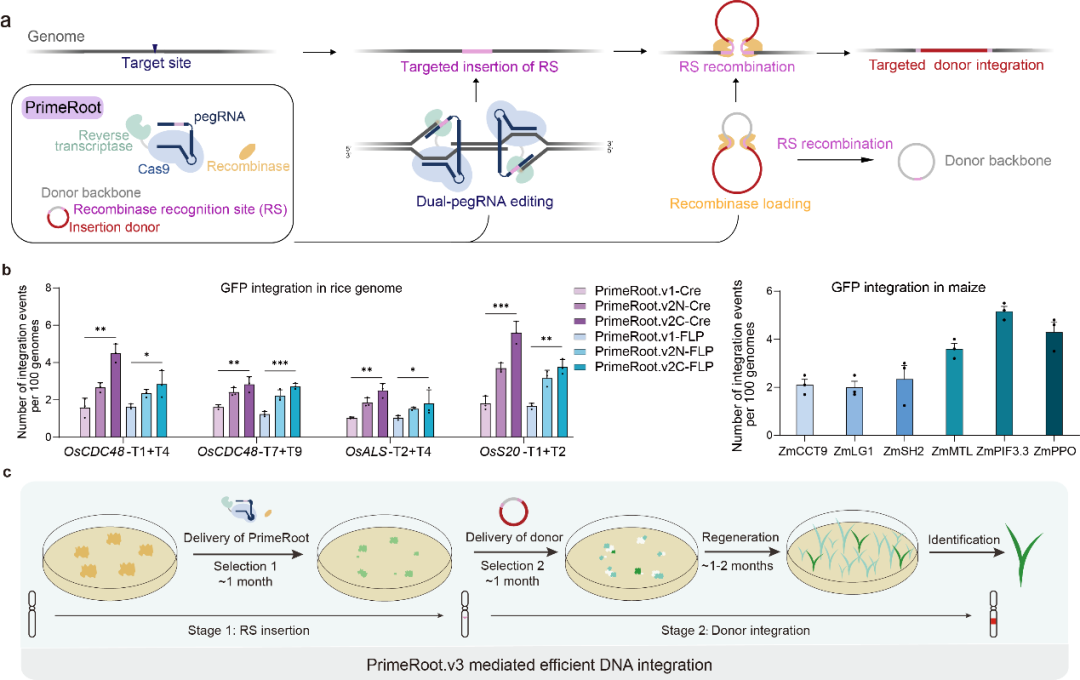
PrimeRoot编辑器的建立及优化。a,PrimeRoot编辑器的原理及模式示意图;b,不同构建形式的PrimeRoot在水稻和玉米中的编辑效率;c,连续转化法介导的高效PrimeRoot示意图。
综上所述,研究人员通过工程化结合引导编辑器与位点特异性重组酶,开发了能够在植物中实现10kb以上大片段DNA高效精准定点插入的PrimeRoot系统,该系统将为基于基因堆叠的植物分子育种和植物合成生物学研究提供有力的技术支撑。
高彩霞课题组博士生孙超、雷源和李帛树为论文共同第一作者,高彩霞研究员与北京齐禾生科生物科技有限公司的Kevin Zhao博士为论文共同通讯作者。中国农业大学刘俊教授、中科院遗传发育所王延鹏研究员参与了该研究。该研究得到国家重点研发计划项目、中国科学院战略重点项目、中国农业农村部和国家自然科学基金委等的经费资助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


