中国科学院最新Cell:于乐谦/王红梅团队等建立“人工胚胎-人工子宫”胚胎植入3D芯片,动态解析人类胚胎植入生理病理全过程
来源:生物世界 2025-12-24 09:34
该研究基于微流控芯片技术建立了 3D 人类胚胎植入模型(人工/自然囊胚植入人工子宫),实现了首次在实验室精准复刻人类胚胎植入过程,为研究人类胚胎植入的细胞和分子机制提供重要模型。
胚胎植入是指发育至囊胚阶段的胚胎通过与母体子宫内膜发生定位、附着并最终入侵内膜基质的过程,是成功妊娠的第一步。胚胎植入失败,严重影响女性健康及出生人口数量。因此,对胚胎植入的研究至关重要。然而,胚胎植入发生于子宫内,无法直接研究。因此,迫切需要在体外建立人胚胎植入模型,还原真实的胚胎植入过程及植入后胚胎发育。
2025 年 12 月 23 日,中国科学院动物研究所于乐谦研究员、王红梅研究员、得克萨斯大学西南医学中心吴军教授、中国农业大学魏育蕾教授、北京妇产医院杨晓葵教授团队合作(李谦、元杨、赵文涛、李圆君、修雨、韩米为论文共同第一作者),在国际顶尖学术期刊 Cell 上发表了题为:A 3D In Vitro Model for Studying Human Implantation and Implantation Failure 的研究论文。
该研究基于微流控芯片技术建立了 3D 人类胚胎植入模型(人工/自然囊胚植入人工子宫),实现了首次在实验室精准复刻人类胚胎植入过程,为研究人类胚胎植入的细胞和分子机制提供了重要模型,也为治疗反复胚胎植入失败(Recurrent implantation failure,RIF)患者的个性化药物筛选与干预提供了全新潜在方案。

生命起始于精卵结合形成受精卵,受精卵分裂为 2 细胞、4 细胞、8 细胞直到形成多细胞的桑椹胚。受精后约第 5 天,胚胎发育形成中空的囊胚。受精后约第 7 天,晚期囊胚通过“定位-粘附-侵入”三个阶段最终侵入子宫内膜基质,从而与母体建立稳固的生理连接。这一过程受到雌激素与孕酮的精密时序调控,并依赖于胚胎发育潜能与子宫内膜“植入窗”(一个短暂的接受窗口)的严格同步。由于伦理和材料的限制,对人类胚胎植入的认识极为有限。因此,迫切需要建立人胚胎植入研究模型,在体外还原真实的胚胎植入过程及植入后胚胎发育。
近年来快速发展的灵长类胚胎体外培养、干细胞胚胎模型与类器官技术为体外搭建人类胚胎植入研究模型提供了新的可能。团队基于过去研究基础,成功构建了一种将人干细胞构建的人工囊胚(blastoid),或临床捐赠的人自然囊胚(blastocyst)与微流控芯片内的 3D 人工子宫(Endometrioid)共培养的体外人类胚胎植入模型。
技术革新:从“静态基质” 到“动态功能组织”,体外重构人类子宫结构
由于技术的限制, 此前对子宫内膜的三维模拟,主要采用胶原蛋白和基质胶 等合成基质,这类基质能提供物理支撑,但无法模拟子宫内膜的激素响应功能,如无法在雌激素、孕酮调控下进入“种植窗期”,也无法分泌支持胚胎植入的关键因子(例如 SPP1、LIF);或者,在子宫内膜腺体类器官的基础上添加基质细胞,所形成的类子宫呈水滴状,不符合自然子宫内膜的生理结构,并且在硬度、选择性支持胚胎植入等方面也与自然子宫差别显著。
本研究创新性的构建动态功能化的 Endometrioid——从人的子宫内膜活检样本中分离上皮细胞和基质细胞,经体外扩增培养后,结合微工程学技术,在微流控芯片中将内膜细胞与经优化的水凝胶基质进行整合。该人工子宫模型的组织硬度(杨氏模量)被调节至与体内孕期子宫组织(171-250 Pa)高度接近,并成功保留了子宫内膜细胞的激素响应能力——经分泌期相关激素诱导后,模型中孕酮响应基因 HSD17β2 的表达量提升 5 倍,PAX8 表达量提升 3 倍,证明其已具备容受期子宫内膜的功能特征。能够在体外成功模拟人类子宫结构与生理功能。
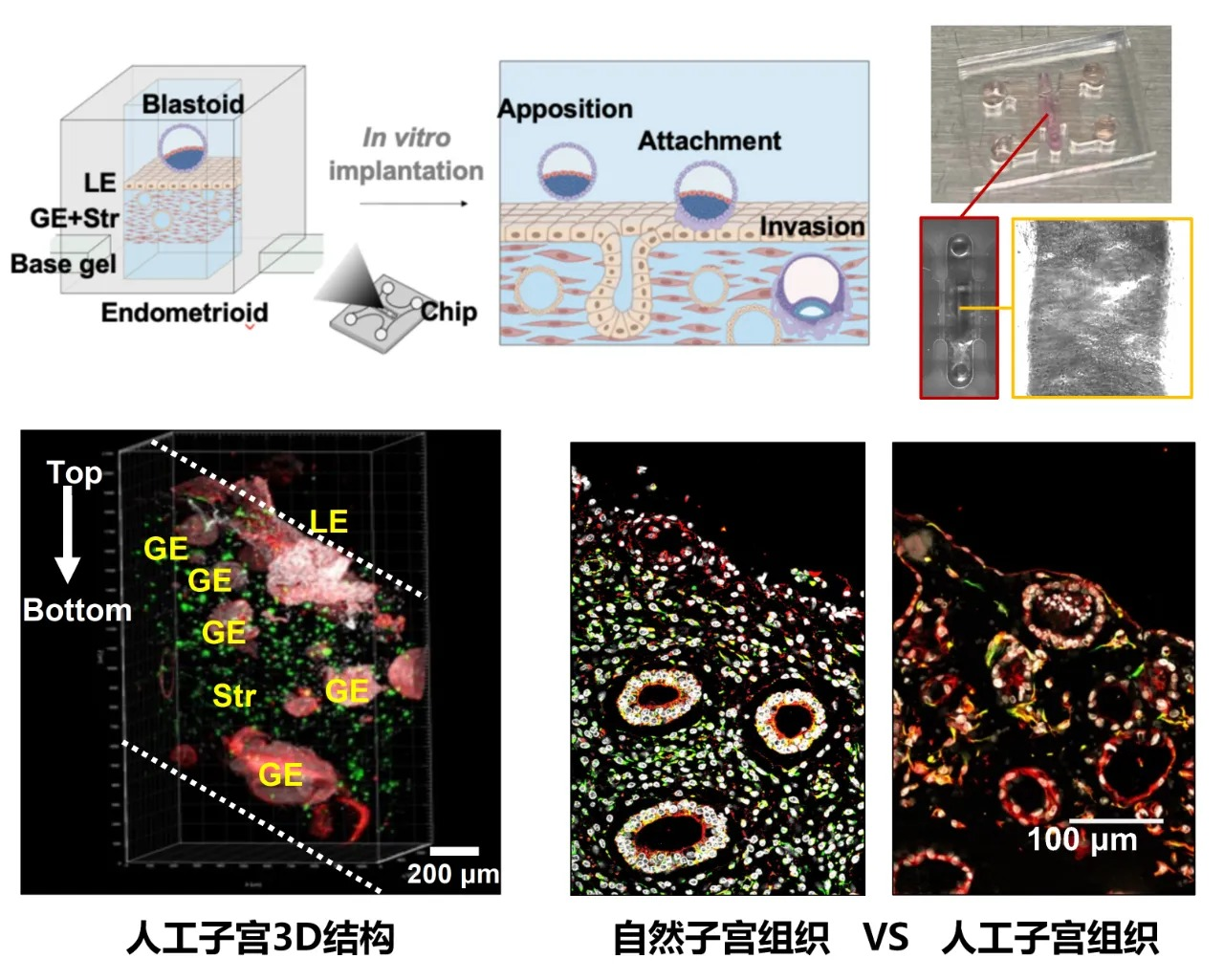
利用生物工程技术体外构建3D人工子宫
科学发现:首次精细解析人类“胚胎-母体对话”分子调控网络,填补认知空白
由于结构的限制, 此前的胚胎植入模型最多能观察到胚胎附着在基质表面、也无法支持胚胎自发入侵到子宫组织,因此无法判断“胚胎选择性的植入能力”以及“胚胎能否真正发育”。
该研究通过微流控芯片构建“分层培养体系”——底层为细胞外基质凝胶,中层为 Endometrioid 核心,上层为腔上皮单层,模拟体内子宫内膜的分层结构。该体系不仅能让胚胎(包括自然囊胚以及干细胞构建的人工囊胚)在分泌期激素的辅助下完成“定位-附着-入侵”的完整过程,还成功支持人植入后胚胎发育至体内 12-14 天的阶段:类囊胚/囊胚植入后 3-5 天,可分化出合体滋养层细胞(STB,hCG 阳性)、绒毛外滋养层细胞(EVT,HLA-G 阳性);7 天后,能形成由 OCT4 阳性细胞构成的原羊膜腔(A.C.)、GATA6 阳性细胞构成的原卵黄囊(Y.S.)。
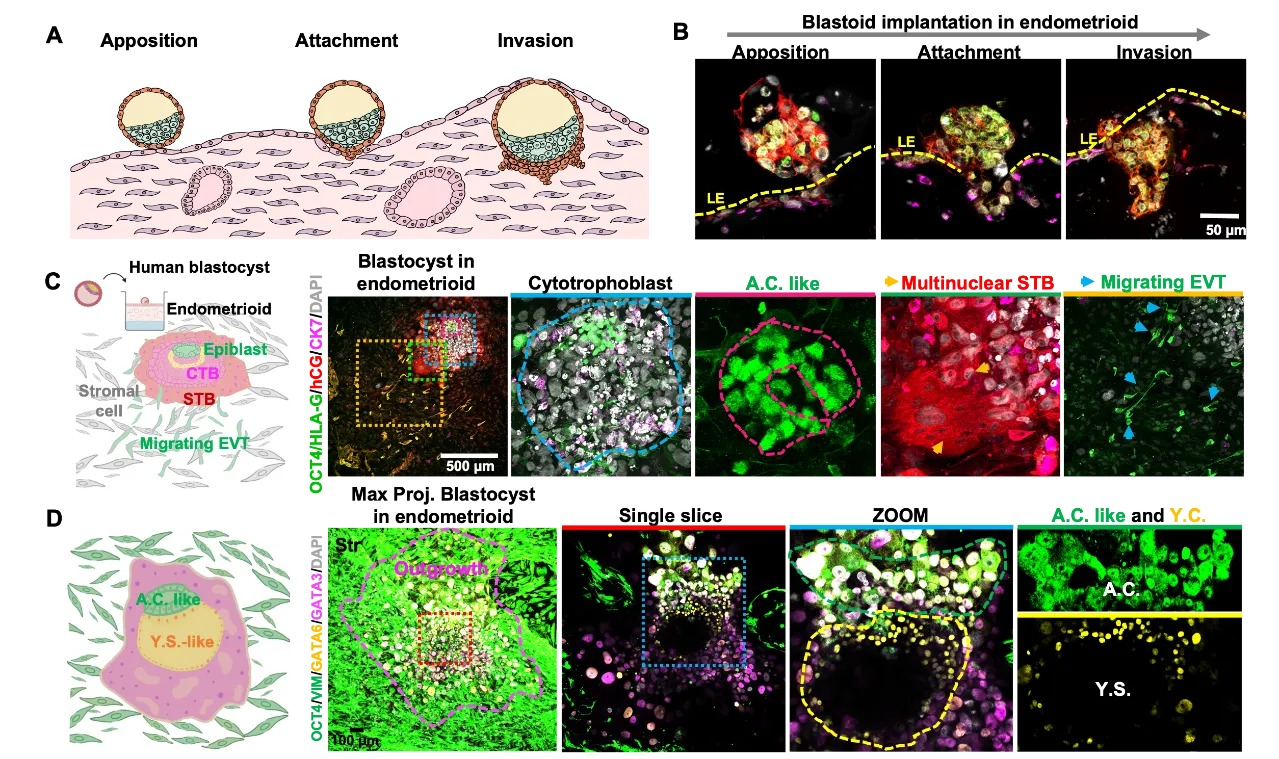
实现人自然/人工胚胎植入及早期发育体外模拟
基于胚胎植入 3D 模型,研究首次系统解析了“胚胎-母体对话”的分子机制,明晰了着床过程的调控网络。研究团队通过单细胞RNA测序技术,对着床后 24 小时与 72 小时的囊胚及子宫内膜细胞进行转录组分析,发现囊胚中的极性滋养层样细胞与子宫内膜腔上皮细胞之间的相互作用最为显著,二者主要通过 CGAFSHR、VEGFAVEGFR1 等配体-受体对进行信号沟通。
其中,VEGFAVEGFR1 通路促进上皮细胞形成“附着位点”,而 CGAFSHR 通路则抑制上皮细胞凋亡。使用抑制剂阻断上述通路后,囊胚附着率显著降低,证实这些相互作用在人类胚胎着床与发育过程中发挥重要功能。
临床应用:快速筛选个性化药物,助力反复种植失败的治疗
反复胚胎植入失败(RIF)发病机制复杂,传统 RIF 治疗多为“广谱尝试”,效果参差不齐。该研究模型成功地模拟了反复植入失败患者的病理特征,并展现出良好的药物筛选潜力。研究显示,来源于 RIF 患者的子宫内膜模型在转录组水平上与健康人群存在明显差异。基于此,研究团队利用该模型对 1119 种已获FDA批准的化合物进行筛选,针对不同 RIF 患者的子宫内膜样本,成功鉴定出一批能够显著提升胚胎附着效率的候选药物。
在后续实验验证中,部分药物不仅改善了 RIF 患者子宫内膜细胞的活力,还成功促进了人工囊胚在患者来源子宫内膜病理模型中的植入与发育,支持其形成羊膜腔样及卵黄囊样结构。该结果在人类捐赠自然胚胎的实验中也得到了进一步验证。
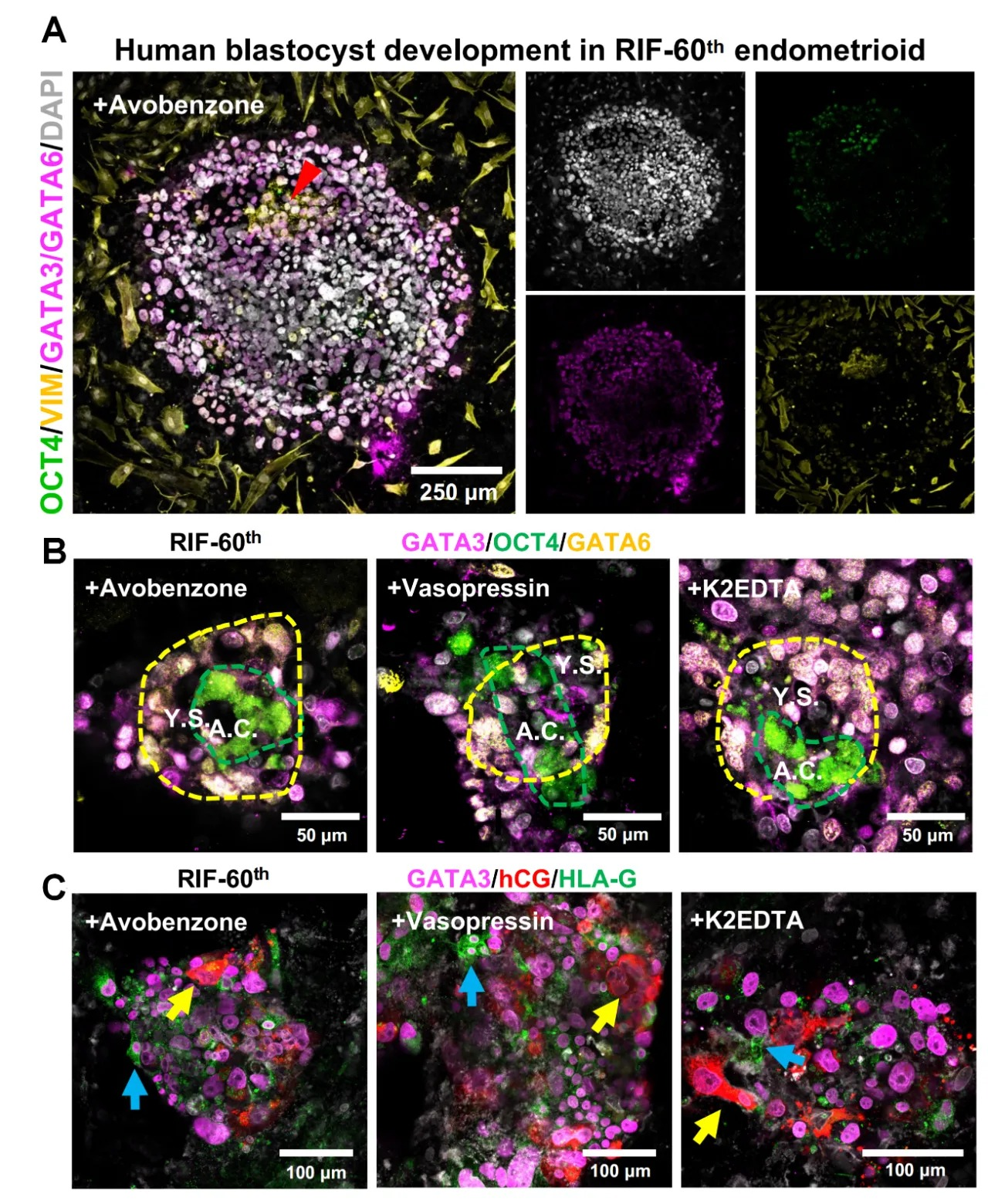
使用 RIF 植入模型(RIF-60th 患者)进行潜在药物筛选
综上,于乐谦及合作团队基于人工胚胎技术,进一步开发的人类胚胎植入 3D 模型,成功突破了传统研究方法的局限。该模型不仅为人类胚胎着床研究开辟了符合伦理的可行路径,也搭建了一个高仿真、大通量、可调控的体外研究体系。这一平台为深入揭示胚胎与子宫内膜相互作用的分子机制,以及研究着床相关疾病的病理机制提供了全新视角。
同时,该模型还可作为针对反复植入失败等不孕症的个体化药物筛选工具,推动相关诊疗策略的发展。此项成果标志着人类早期胚胎发育研究正从“难以观察”迈入“精准解析”的新阶段。
论文链接:
https://www.cell.com/cell/abstract/S0092-8674(25)01230-9
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


