国内首次! 我国生物工业界揭示ADC耐药机制,并展示新一代ADC技术平台
来源:生物世界 2023-02-02 18:01
论文作者特别指出,因为ADC是一个包括了生物和化学原件的整合体,需要全体系的设计和验证,包括连接子和载荷化学,ADC整体的分子作用机制,生物学和药理等。
抗体偶联药物(Antibody-drug conjugate,ADC), 从这个概念的提出(Magic Bullet, Paul Ehrlich, 1913)到第一款ADC药物的成功问世(Mylotarg, Pfizer Inc., 2000),科学家用了将近百年的时间。而又经过了10年的沉寂后,ADC药物开始逐渐绽放出它的魅力所在。
如今,越来越多的机构和企业投入到了ADC药物研发的领域,经过多个ADC技术和产品的迭代,Trodelvy和Enhertu(DS-8201a)的问世将可裂解连接子-喜树碱类的ADC药物推入了公众的视线,后者更是将ADC的“准入门槛”提升到了一个新的高度。尽管如此,(除了在少数肿瘤之外,比如乳腺癌)这些ADC在绝大部分肿瘤病人中仍然疗效不佳,而且几乎都会遇到天然和获得性耐药,因此存在较大的改进空间。深刻并准确理解DS-8201a或TrodelvyY的耐药机制成为变得需要和迫切。
近日,我国制药企业普众发现(Multitude Therapeutics)的研究团队在癌症研究领域顶刊 Cancer Discovery 上发表了题为:Antibody-exatecan conjugates with a novel self-immolative moiety overcome resistance in colon and lung cancer 的研究论文。
该研究详尽揭示了DS-8201a(及其他DXd家族ADC)和TRODELVY的耐药机制进,并且以此为基础设计,筛选出一类新型ADC——T moiety-exatecan ADC。
与现有技术相比,这一新技术得益于更优的“疏水屏蔽效应”与稳定性,大幅度提高了ADC治疗效果,延长了药物作用时间,能够克服多重肿瘤耐药性,重要的是毒副作用并没有增加,进一步提升了现有ADC药物的治疗窗口。T moiety-exatecan ADC有望成为“后8021”时代的下一代ADC的代表。

研究团队选择依喜替康(Exatecan,Topoisomerase I inhibitor),作为载荷,对比研究了DXd和SN-38另外两种同类型的毒素。通过多种机理的研究证实依喜替康具有杀伤能力强,作用速度快,多重耐药机制(MDR)影响小等的独特抗肿瘤载荷优势。研究团队基于该载荷开发了一系列的“T moiety”连接子并从ADC理化性质和细胞水平的抗肿瘤活性进行了全面的评估,确定了T800-T1000作为优选的依喜替康连接子, 克服了依喜替康因为其过强的疏水性导致无法直接偶联抗体的特性,并赋予了ADC更强的旁观者效应和肿瘤浸润能力。
重要的是,该研究比较了多个连接子亲水修饰化学(PEG,糖苷酶等)和位点(多肽或者MC)。通过筛选,确定了在距离载荷距离最近的自我断裂结构pAB上修饰比于其他位点修饰更能够增加ADC的稳定性和亲水性。T800-T1000的修饰化学也比PEG和糖苷酶等经典亲水修饰更有优势。
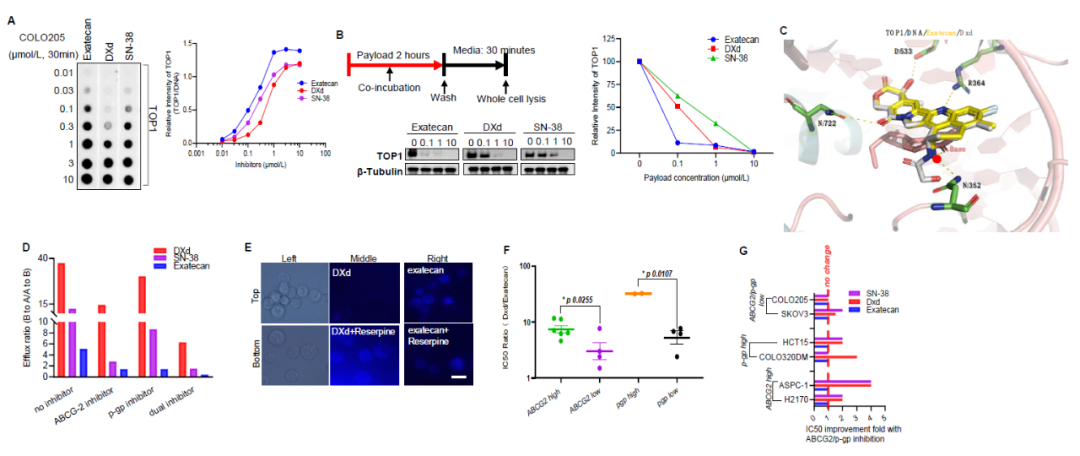
图1. Exatecan/DXd/SN-38机理研究 (图片来源:参考资料1)
研究团队应用T1000偶联技术,进一步在多个成药靶点上(HER2, TROP2, HER3, CDH6)进行了“头对头”的抗肿瘤活性药效实验研究。药效模型包含了多个不同的适应症(肺癌、结直肠癌、胰腺癌、肾癌等),不同的模型类型(CDXs、PDXs、syngeneic mouse model),不同的MDR特征,并且涵盖了所有研究靶点的表达量高低以及癌症主要基因突变类型。通过这样一套全面的小鼠体内药效数据,充分证明了“T moiety”技术相比较现有的DXd/SN-38偶联技术更加优秀的抗肿瘤活性和更宽广的适用性。
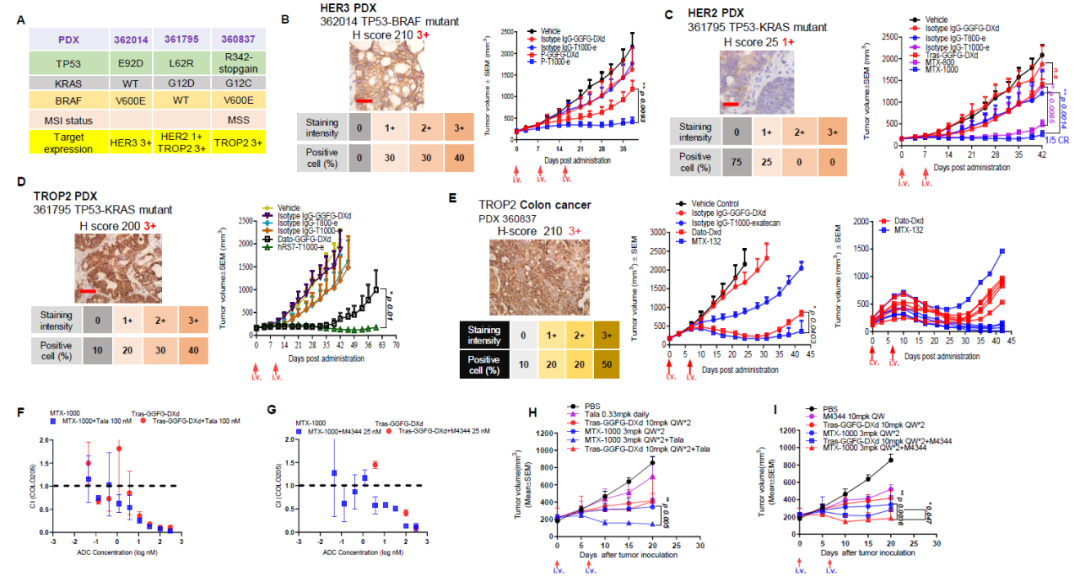
图2. 体内药效研究 (图片来源:参考资料1)
在药物的安全性方面,研究团队进行了大鼠和食蟹猴的毒理实验,并在体外细胞水平进行了骨髓抑制毒性实验,实验结果证明虽然依喜替康作为小分子药物在抗肿瘤活性强于DXd/SN-38的同时,毒性也相对更强,但是通过T1000偶联技术将其作为载荷开发成ADC药物之后,ADC药物的毒性被成功的有效控制在了和DXd/SN-38类ADC药物相当的一个水平,相比于DS-8201a和Trodelvy,数倍提升了治疗窗口。同时展示出T moiety化学增加ADC稳定性,降低毒性的特点。
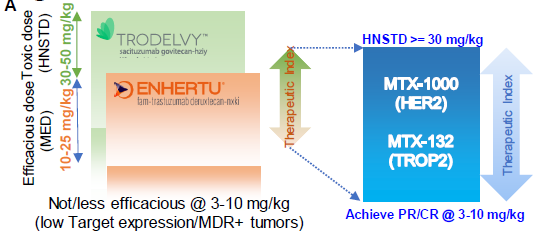
图3. 治疗窗口比较 (图片来源:参考资料1)
同样重要的是,研究数据显示T moiety-exatecan ADC和其他抗肿瘤分子有协同效应,从而为这类ADC的临床联用策略提供了基础。在肠癌中,T moiety-exatecan ADC和DNA损伤通路的抑制剂联用显示出更好的肿瘤抑制效果。和PD-1联用,针对HER2的T moiety-exatecan ADC MTX-1000显示出比DS-8201a更强的协同效应。
除了“T moiety”连接子技术平台的独特优势之外,作为来自国内的工业界研究团队首次将尚未取得临床数据的原创ADC新药研究成果展现于癌症领域国际顶级期刊,还获益于以下具有亮点和特色的研究:
1、首次将喜树碱类毒素载荷及对应ADC药物进行了详尽和严谨的基础研究,包括从分子的设计理念、结构与机理特征、分子理化性质研究,拓展到耐药底物和机制研究、深入的药效学及毒性研究等。
2、通过大量的PDX模型实验以及前沿的类器官技术,加强临床转化研究的深度和广度;通过不同类型的药物毒性研究实验,进一步预测药物的有效性和安全性。
3、T moiety化学具体广泛的拓展性和应用场景。T moiety化学可以算作“click”化学,可以直接链接经典多肽连接子和多种不同作用机制的载荷分子。因此,T moiety可以用来构建双载荷的ADC分子,包括不同机理的细胞毒素或者免疫激动剂。
最后,论文作者特别指出,因为ADC是一个包括了生物和化学原件的整合体,需要全体系的设计和验证,包括连接子和载荷化学,ADC整体的分子作用机制,生物学和药理等。希望该研究的方法学可以为ADC领域提供一个标准和参考,持续提升ADC研究的高度和深度。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


