2021年5月Cell期刊不得不看的亮点研究
来源:本站原创 2021-05-31 23:48
2021年5月31日讯/生物谷BIOON/---2021年5月份即将结束了,5月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Cell:通过分析全球60个城市的近5000份样本,发现大约1.2万种之前从未发现的细菌和病毒doi:10.1016/j.cell.2021.05.002国际MetaSUB联盟(Internationa
2021年5月31日讯/生物谷BIOON/---2021年5月份即将结束了,5月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:通过分析全球60个城市的近5000份样本,发现大约1.2万种之前从未发现的细菌和病毒
doi:10.1016/j.cell.2021.05.002
国际MetaSUB联盟(International MetaSUB Consortium)是一项由威尔康奈尔医学院的研究人员领导的追踪微生物的全球努力。根据国际MetaSUB联盟的一项新的研究,在2015年至2017年期间从世界各地的公共交通系统和医院的取样中收集的大约12000种细菌和病毒以前从未被鉴定过。相关研究结果于2021年5月26日在线发表在Cell期刊上,论文标题为“A global metagenomic map of urban microbiomes and antimicrobial resistance”。
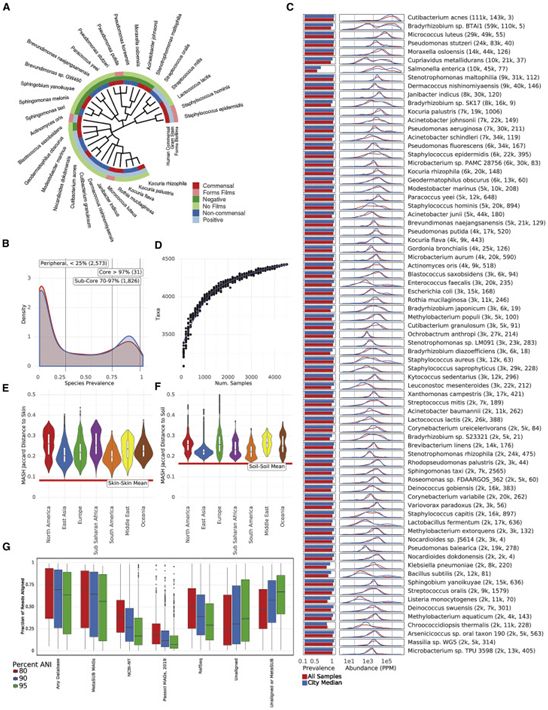
核心微生物组,图片来自Cell, 2021, doi:10.1016/j.cell.2021.05.002。
这项新的研究发现了10928种病毒和748种细菌,这些病毒和细菌在任何现有的参考数据库中都不存在。这一领域的研究对于检测已知和未知感染的爆发以及研究不同城市环境中抗生素抵抗性微生物的流行具有重要意义。
2.Cell:首次发现在感染SARS-CoV-2后既会产生抵御感染的中和抗体,也会产生增强感染的抗体
doi:10.1016/j.cell.2021.05.032
结合SARS-CoV-2刺突蛋白的受体结合位点(RBD)的抗体作为中和抗体发挥了重要的功能:通过抑制SARS-CoV-2与人类受体ACE2的结合来抑制这种病毒的感染。另一方面,结合SARS-CoV-2刺突蛋白其他位点的抗体的功能是未知的。
在一项新的研究中,日本研究人员通过分析来自COVID-19患者的抗体,首次发现在感染SARS-CoV-2后既会产生抵御感染的中和抗体,也会产生增强感染的抗体(infection-enhancing antibodies,即感染增强性抗体)。相关研究结果于2021年5月24日在线发表在Cell期刊上,论文标题为“An infectivity-enhancing site on the SARS-CoV-2 spike protein targeted by antibodies”。
他们发现,当感染增强性抗体与SARS-CoV-2刺突蛋白表面上的一个特定位点结合时,这些抗体直接引起刺突蛋白的构象变化,从而导致SARS-CoV-2的感染性增加。中和抗体识别刺突蛋白的RBD,而感染增强性抗体识别刺突蛋白的N端结构域(NTD)的特定位点。此外,感染增强性抗体的产生削弱了中和抗体预防感染的能力。
在重症COVID-19患者中发现了更高的感染增强性抗体的产生。他们还发现,非感染者可能有少量的感染增强性抗体。尽管感染增强性抗体的产生可能参与了重症疾病的产生,但还需要进一步分析以确定它们是否真地参与了体内感染的加剧。
3.Cell:揭示一种罕见的以前未知的巨噬细胞与治疗后的肾癌复发有关
doi:10.1016/j.cell.2021.04.038
与其他癌症相比,肾癌的免疫特性非常突出:与大多数其他实体瘤相比,有更多的免疫细胞浸润肾癌,而且肾癌是对当今免疫治疗方案反应最强烈的恶性肿瘤之一。然而,尽管进行了治疗,许多肾透明细胞癌(clear cell renal carcinoma,最常见的肾癌类型)患者最终还是会复发,并出现无法治愈的转移性疾病。
在一项新的研究中,美国研究人员发现肾脏肿瘤中存在一种罕见的、以前未知的免疫细胞类型,可以预测哪些患者在手术后可能会出现癌症复发。这些细胞甚至可能驱动侵袭性疾病。这些结果表明这些细胞的存在可能用来识别手术后疾病复发的高风险患者,这些患者可能是更积极的治疗的候选对象。相关研究结果于2021年5月20日在线发表在Cell期刊上,论文标题为“Single-cell protein activity analysis identifies recurrence-associated renal tumor macrophages”。
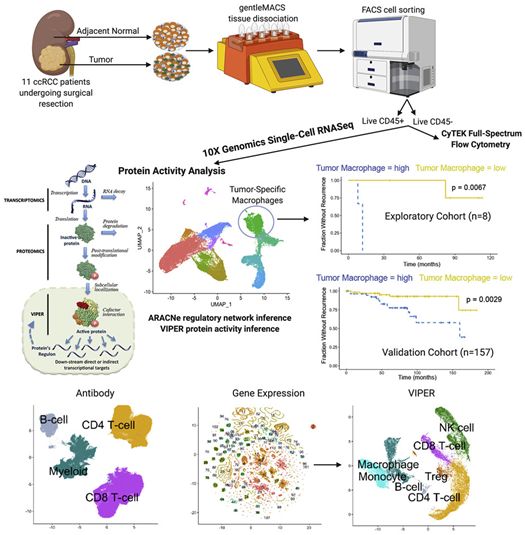
图片来自Cell, 2021, doi:10.1016/j.cell.2021.04.038。
此外,这些巨噬细胞被发现通过成对的受体-配体基因与肿瘤细胞直接相互作用。这些数据提出了一种耐人寻味的可能性,即这些巨噬细胞不仅仅是更危险的疾病的标志,而且实际上可能导致疾病的复发和进展,而且靶向这些巨噬细胞可以改善临床结果。
4.Cell:发现一组抗聚糖抗体可有效地中和HIV病毒
doi:10.1016/j.cell.2021.04.042
天然抗体可以靶向病原体表面上的宿主聚糖。在一项新的研究中,来自美国杜克大学人类疫苗研究所的研究人员报告,一组新发现的与HIV病毒外壳上的聚糖结合的抗体能够有效地中和这种病毒,并指出一种新的疫苗方法也可潜在地用于对抗SARS-CoV-2和真菌病原体。相关研究结果于2021年5月20日在线发表在Cell期刊上,论文标题为“Fab-dimerized glycan-reactive antibodies are a structural category of natural antibodies”。
这些作者描述了在猴子和人类中发现的一类免疫细胞,它们产生一种独特的抗聚糖抗体(anti-glycan antibody)。这种新描述的抗体有能力附着在HIV外层的聚糖斑(a patch of glycans)上。这些聚糖斑是链状糖结构,类似于存在于宿主细胞表面上的聚糖。
这代表了一种新的宿主防御形式。这些新发现的抗体具有一种特殊的形状,可能对各种病原体有效。这些作者是在一系列探索是否存在靶向覆盖HIV外表面的聚糖的免疫反应中发现了这种抗体。
5.Cell:揭示致病性的弗氏志贺菌让人自然杀伤细胞失活机制
doi:10.1016/j.cell.2021.04.036
作为一个大型的蛋白家族,成孔溶细胞素(pore-forming cytolysin)已知通过促使受感染的人类细胞自我毁灭来阻止细菌感染扩散。如今,在一项新的研究中,来自美国德克萨斯大学西南医学中心的研究人员发现这个大型蛋白家族的一个成员,即Gasdermin B(GSDMB),似乎反而能杀死传染性细菌。然而,一些细菌有自己的机制来挫败这种攻击,通过标记GSDMB使之遭受破坏来让这种致命的蛋白失效。相关研究结果于2021年5月21日在线发表在Cell期刊上,论文标题为“Pathogenic ubiquitination of GSDMB inhibits NK cell bactericidal functions”。
以前的研究已表明,蛋白GSDMB与哺乳动物gasdermin家族的其他成员不同。相关的gasdermin蛋白在受感染的细胞膜上形成孔隙,在杀死它们的同时允许炎症分子渗出并引发免疫反应。然而,在人类中发现但在包括啮齿动物在内的一些其他哺乳动物物种中没有发现的GSDMB在体外培养的哺乳动物细胞膜上不形成孔隙,使得它的作用靶标成为一个谜。
这些作者利用一种新的筛选技术,发现一种来自引起腹泻病的弗氏志贺菌(shigella flexneri)的称为IpaH7.8的蛋白毒素直接抑制GSDMB。生物化学实验表明,IpaH7.8给GSDMB打上了一个化学标记,使之泛素化,这标志着它将遭受破坏。
为了了解为何弗氏志贺菌会清除人类细胞中的GSDMB,这些作者将GSDMB置于合成的哺乳动物和细菌细胞膜内。虽然GSDMB没有伤害到合成的哺乳动物细胞膜,但它在细菌的细胞膜上戳了一个孔。进一步的调查显示,称为自然杀伤细胞的免疫细胞刺激了这一过程。
6.Cell:新冠病毒英国变种B.1.1.7于2020年12月传入美国,并迅速传播
doi:10.1016/j.cell.2021.03.061
在一项新的研究中,来自美国耶鲁大学公共卫生学院的研究人员利用来自英国和其他受SARS-CoV-2 B.1.1.7变种影响严重的国家的入境航班数据,首次报告了这种变种在美国的传入数量和传播程度。相关研究结果发表在2021年5月13日的Cell期刊上,论文标题为“Early introductions and transmission of SARS-CoV-2 variant B.1.1.7 in the United States”。
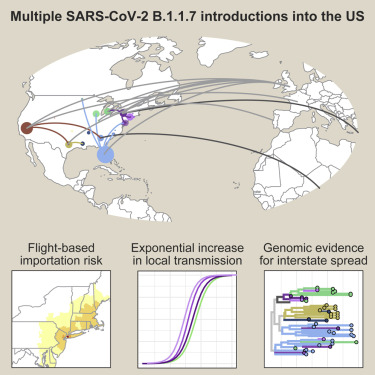
新冠病毒英国变种B.1.1.7多次传入美国,图片来自Cell, 2021, doi:10.1016/j.cell.2021.03.061。
B.1.1.7变种被认为比导致COVID-19大流行的原始病毒更具传播性和毒性,到2020年12月,该变种被发现已经在美国境内建立并传播。这些作者对基因组数据进行先进的系统地理学分析来获得他们的发现。
7.Cell:重磅!科学家开发出全球首个自组装的人类心脏类器官!
doi:10.1016/j.cell.2021.04.034
能够形成组织样结构的器官能够改变我们模拟人类发育和疾病发生的能力,除了人类心脏的案例外,谱系特异性的自组装类器官在所有主要的器官中都已经被报道了。日前,一篇刊登在国际杂志Cell上题为“Cardioids reveal self-organizing principles of human cardiogenesis”的研究报告中,来自维也纳生物中心等机构的科学家们通过研究成功利用人类多能干细胞培育出了芝麻大小的心脏模型,成为心脏型类器官(cardioids),其能自发地自组装并形成一个空腔,而并不需要实验支架;这一研究进展就有望帮助科学家们创建一些迄今为止最逼真的心脏器官。
此前,研究人员通过组织工程技术来建立3D心脏类器官,这一方法通常会涉及组装细胞和支架,就好像利用砖头和砂浆来建造房屋一样;但这些工程化的类器官并不具有与人类心脏相同的应对损伤的生理学反应,因此往往不能作为良好的疾病模型。研究者Mendjan说道,组织工程技术对于很多事情都非常有用,比如如果你想对收缩性进行测量等;但在自然界中,器官并不是这样建立的。在胚胎中,器官会通过一种称之为自组装的方式来自发进展;而且在发育过程中,细胞的基本构建会相互作用,随着器官结构的出现和生长,其会四处移动并改变形状。
自组装是自然界如何形成雪花晶体或鸟类的群体性行为的方式,这是很难进行设计的,因为其发生似乎并没有什么计划,但仍然有一些非常强大且有序的东西会出现;器官的自组装要动态地多,而且有很多事情科学家们是并不了解的。这项研究中,研究者Mendjan及其团队就想通过研究在培养皿中通过自我组装来模拟器官的发育过程,他们通过激活参与胚胎心脏发育的所有六种已知的信号通路,以一种特定的顺序来诱导干细胞进行自组装;随着细胞的分化,这些干细胞就开始形成独立的层状结构,这类似于心脏壁的结构;当发育一周后,这些类器官就会自组装形成拥有封闭空腔的3D结构,这是一种类似于人类心脏的自我生长轨迹,此外,研究者还发现,心脏类器官壁样组织能够有节律地收缩,将液体挤压到空腔内部中去。研究者Mendjan说道,或许并不是我们使用的东西与其它研究人员不同,而是我们只使用了所有已知的信号;他还补充道,并非所有通路都需要引导干细胞成为心脏细胞,因此它们或许在体外并非是必需的,但事实证明,所有这些途径都是必要的,其对于使细胞自组装成为一个器官非常重要。
8.Cell:揭示一种微调基因转录的新机制,并指出CDK9抑制和PP2A激活同时进行会增强抗癌效果
doi:10.1016/j.cell.2021.04.022
因表达是基因所编码的信息用于制造蛋白的过程。基因转录是基因表达的至关重要的一步。控制基因表达的时间和水平对于细胞在有机体中发挥其特定功能、适应周围环境和对外部刺激作出适当反应至关重要。癌症是基因表达失去调控的结果,因为在错误的时间或在错误的细胞中开启或关闭一个或多个基因可以极大地改变它们的整体行为并导致无限制的生长。
在一项新的研究中,来自美国和澳大利亚的研究人员发现了一种对基因转录进行微调的新型检查点机制:整合因子蛋白复合物(Integrator protein complex)的一个组分将蛋白磷酸酶2A(PP2A)拴系在转录位点,使得它能够阻断RNA聚合酶II(RNAPII)的活性。这一机制遭受破坏可导致不受限制的基因转录,并与癌症产生有关。这项研究为治疗干预提供了新的可行机会,并展示了一种新的组合疗法在实体瘤和血液恶性肿瘤的临床前模型中的抗癌效果。相关研究结果于2021年5月17日在线发表在Cell期刊上,论文标题为“The PP2A-Integrator-CDK9 axis fine-tunes transcription and can be targeted therapeutically in cancer”。
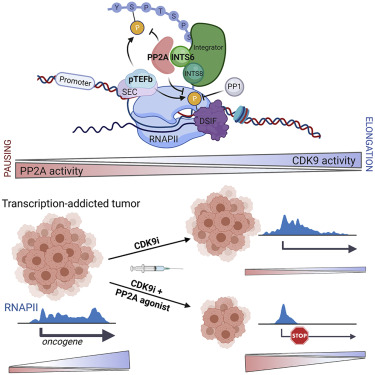
一种微调基因表达的新机制示意图,图片来自Cell, 2021, doi:10.1016/j.cell.2021.04.022。
这些作者发现,作为转录过程的一种至关重要的调节因子,整合因子蛋白复合物的一个组分与PP2A磷酸酶相互作用,将它招募到转录位点,在那里抵消CDK9的活性,并阻止转录延伸。PP2A和CDK9协同工作,微调转录的激活和抑制之间的平衡。
随后,这些作者测试了这样的一个假设:通过同时阻断CDK9和激活PP2A来靶向癌症中的PP2A-Integrator-CDK9轴,可以为白血病和实体癌的小鼠模型提供治疗效果。CDK9抑制剂(CDK9i)和PP2A的小分子激活剂(small molecule activators of PP2A, SMAP)的联合治疗可以杀死急性骨髓性白血病(AML)细胞,与单独使用其中的任何一种药物相比,可延长治疗效果和显著延长生存期。同样,在实体瘤模型中的这种联合治疗可降低肿瘤生长率和肿瘤体积,从而提高了总生存率。
9.Cell:揭示受精时父本和母本染色体结合在一起极其容易出现差错
doi:10.1016/j.cell.2021.04.013
三次受精中只有一次能成功怀孕。许多胚胎在早期发育之后无法继续发育。如今,在一项新的研究中,来自德国和英国的研究人员开发出一种新的模型系统来研究早期胚胎发育。在这种系统的帮助下,他们发现当来自父本和母本双方的遗传物质在受精后立即结合时,往往会发生错误。这是由于一个明显低效的过程造成的。相关研究结果近期发表在Cell期刊上,论文标题为“Parental genome unification is highly error-prone in mammalian embryos”。
这些作者指出,人们已知道大约10%到20%的含有不正确染色体数量的胚胎是由于卵子在受精前已经含有太少或太多的染色体,但是这个问题怎么会出现在这么多的胚胎中呢?精子和卵子结合在一起后的受精卵阶段似乎是胚胎发育的一个极其关键的阶段。他们想知道其中的原因是什么。
为了开展这项新的研究,这些作者分析了由英格兰一家实验室记录的人类胚胎的显微镜视频。此外,他们还着手寻找一种适合详细研究早期胚胎发育的新型模式生物体。他们开发出研究活牛胚胎的方法,其中牛胚胎与人类胚胎非常相似。人类和牛的胚胎中第一次细胞分裂的时间是相似的。此外,染色体分布不正确的频率在这两种生物系统中大致相同。这种模型系统的另一个优势在于:他们从屠宰场的废物中获得了牛胚胎的卵子,这样就不用再杀死其他动物了。
这些作者在体外使牛卵子受精,然后用活细胞显微镜跟踪亲本遗传物质是如何结合在一起的。他们发现,亲代染色体聚集在两个原核之间的界面上。然而,在一些受精卵中,他们注意到个别染色体未能做到这一点。结果就是这些染色体在亲代基因组结合在一起时发生“丢失”,导致所产生的细胞核中染色体过少。这些受精卵很快就显示出发育缺陷。这表明染色体在原核界面上的聚集似乎是一个极其重要的步骤,如果这种聚集出现故障,那么受精卵往往会出现错误而无法实现健康胚胎发育。
10.Cell:第三次进化革命!首次揭示糖基化的RNA无处不在,而且它们定位于细胞表面上
doi:10.1016/j.cell.2021.04.023
核酸的出现和蛋白的出现有时被称为第一次和第二次进化革命,因为它们使我们所知道的生命成为可能。一些专家认为,糖基化---将聚糖(glycan)添加到其他生物聚合物上---应被视为第三次进化革命,因为它使细胞能够从相同的DNA蓝图中构建无数的分子形式。长期以来,人们认为只有蛋白和脂质才会接受这些碳水化合物的修饰。然而,在一项新的研究中,来自美国斯坦福大学和哈佛大学等研究机构的研究人员发现RNA也可以被糖基化,而且这些被糖包裹的核酸似乎会定位到细胞膜上。这是科学家们有史以来第一次在RNA上观察到这一点。相关研究结果于2021年5月17日在线发表在Cell期刊上,论文标题为“Small RNAs are modified with N-glycans and displayed on the surface of living cells”。
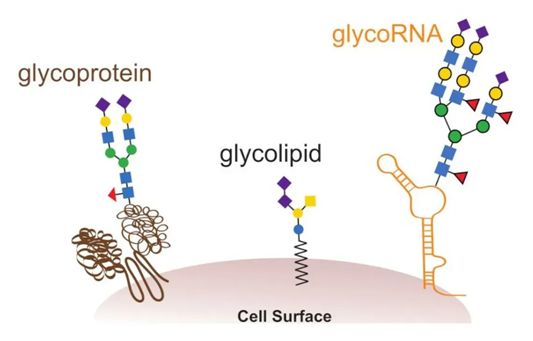
GlycoRNA、糖脂和糖蛋白是细胞糖衣的一部分。图片来自Cell, 2021, doi:10.1016/j.cell.2021.04.023。
这些作者明显分离出一种共价的RNA-聚糖共轭物。然而,巨大的问题仍然存在,包括这些glycoRNA的作用是什么以及它们如何形成。比如,目前还不清楚RNA和聚糖到底是如何物理连接在一起的,如果没有这些信息,一些科学家不太相信这种结合是通过酶的作用发生的。
这些作者认为,RNA的糖基化方式与蛋白的糖基化方式基本相同,甚至需要一些相同的蛋白。正如那篇预印本文章所指出的那样,当他们抑制参与糖基化的关键酶时,glycoRNA以一种剂量依赖的方式消失了。同样,经基因改造后在蛋白糖基化中出现差错的细胞系产生了非常少的glycoRNA。鉴于多个糖基化步骤只有在检查了正确的蛋白折叠后才能进行,RNA与蛋白通过相同的途径进行糖基化将是很奇怪的。因此,科学家们很难想象糖基化在RNA上到底会如何发生。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


