Cell:伤口愈合过程中,组织流动性的动态调节控制着皮肤的修复
来源:生物世界 2024-10-05 11:02
这项发表于 Cell 的研究开发了一种基因小鼠模型,通过单细胞RNA测序、表观遗传分析以及功能实验,确定了伤口愈合过程中组织流动性的动态调节,并揭示了不同表皮干细胞中常见的再生细胞状态。
近日,比利时布鲁塞尔自由大学干细胞与癌症实验室主任 Cedric Blanpain 教授及其团队在国际顶尖学术期刊 Cell 上发表了题为:Dynamic regulation of tissue fluidity controls skin repair during wound healing 的研究论文。
该研究通过单细胞RNA测序和表观遗传图谱分析并联合功能实验,揭示了一种由组织流动性过程中激活的EGFR/AP1轴调节的常见再生状态,这对皮肤干细胞激活和组织修复至关重要,为皮肤损伤的干细胞治疗提供理论基础。

表皮是层状上皮,由构成皮肤屏障的毛囊间表皮(IFE)、毛囊及其相关的皮脂腺以及连接卵泡间表皮和IFE的胚珠组成。成熟的IFE包括一个单一的增殖细胞内层,称为基底层,表达角蛋白14(KRT14),以及几个含有终末分化细胞的基上层。在没有损伤的情况下,不同的表皮隔室由它们自己的室限制性干细胞库维持。
作为抵御外界环境的第一道屏障,皮肤表皮不断受到损伤等伤害,因此需要迅速修复以维持表皮保护功能,避免全身感染。对此,在皮肤损伤后,一系列事件会被快速激活,介导皮肤屏障功能的重建。随着研究的深入,皮肤损伤修复事件的顺序——凝血/炎症期、肉芽期和重塑期,以及所涉及的干细胞类型——包括毛囊膨出干细胞、INF干细胞和IFE干细胞,已经得到了越来越多的描述。
然而,在皮肤再生过程中,干细胞如何被激活并调整其命运以补充祖细胞池,然后返回到稳定状态仍然是一个谜题。此外,目前尚不清楚这些事件是如何与修复过程中组织物理状态的潜在变化相协调的。
在这项最新研究中,研究团队开发了一种基因小鼠模型,可以精确地消除基底表皮细胞,使基底上分化细胞和皮肤的基本结构完好无损,而不会引起出血和凝固。这一小鼠模型允许谱系追踪和基底细胞谱系消除。

基底细胞谱系消融后细胞增殖和表皮再生的动力学
通过这种小鼠模型,基底细胞谱系消除导致IFE祖细胞的强烈耗竭,导致邻近和更远端的干细胞的激活和募集,从而迅速补充基底细胞。此外,联合共聚焦和连续的活体成像,研究团队成功监测到皮肤损伤后的再生过程中的干细胞命运和组织动力学,并确定了细胞动力学的变化和修复过程中组织的物理状态。
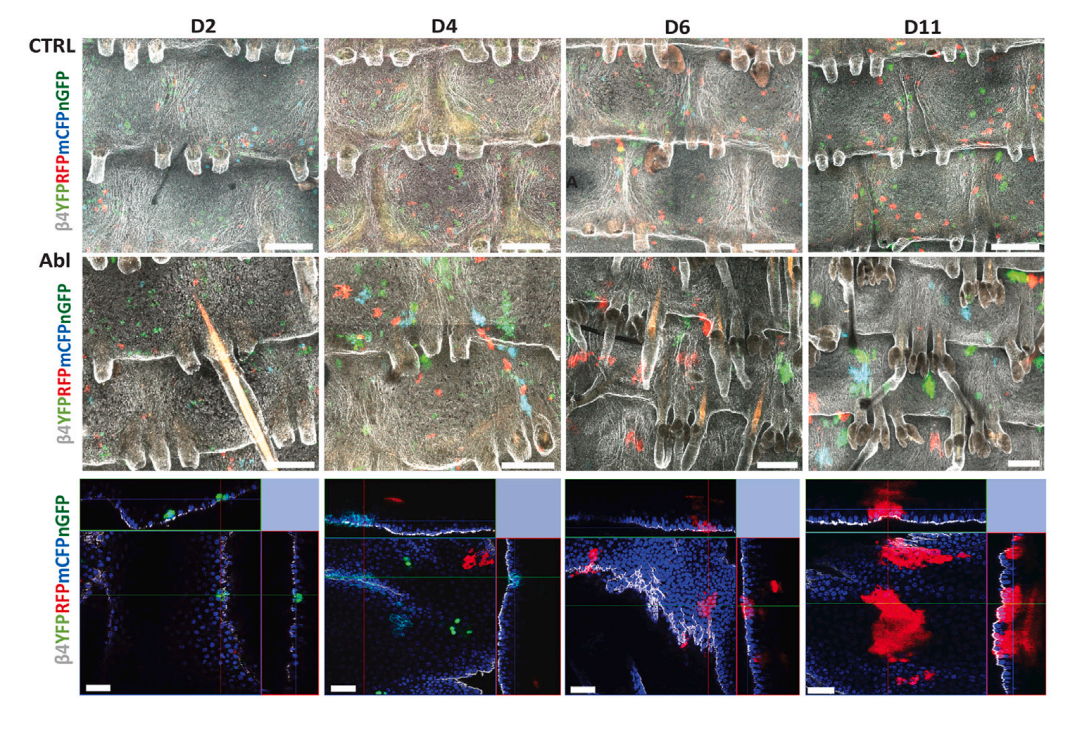
IFE干细胞的对称更新增加介导了基底细胞消除后的表皮再生
对基底细胞重排的分析表明,在修复过程中,基底表皮层在低细胞密度下从固体样稳态过渡到液体样状态,紧接着在上皮化过程中逐渐恢复到固体样稳态。伴随这些物理状态的动态变化,存在于IFE干细胞和Lrig1 INF干细胞中的染色质和转录重塑诱导了一种共同的再生状态,这对促进干细胞更新和组织修复至关重要。
与此相印证,阻断肌动球蛋白收缩力降低了基底细胞重排事件的发生和Jun+细胞的数量,这表明组织流动性最初可能促进Jun/Fos再生状态的激活。
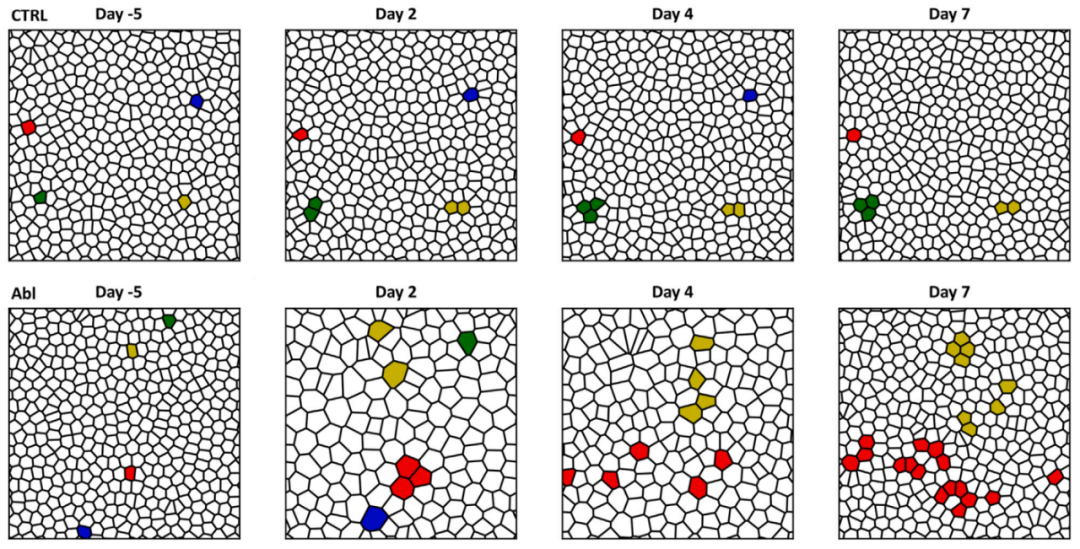
Voronoi数学模型捕捉了组织再生的动态过程
在组织流动性阶段结束时,EREG和其他EGFR配体的分泌导致EGFR/AP1通路的激活,该通路负责促进增殖、再上皮化和组织再生。这与组织流动性的减少有关,并最终过渡回固体样的稳态状态。
此外,EGFR和AP1抑制后的组织流动性增加表明,EGFR/AP1轴直接或间接地抑制基底细胞消融后的组织流动性,可能在这一过程中提供了反馈机制,并且再上皮化和组织修复与表皮内固体状态的逐步恢复有关。
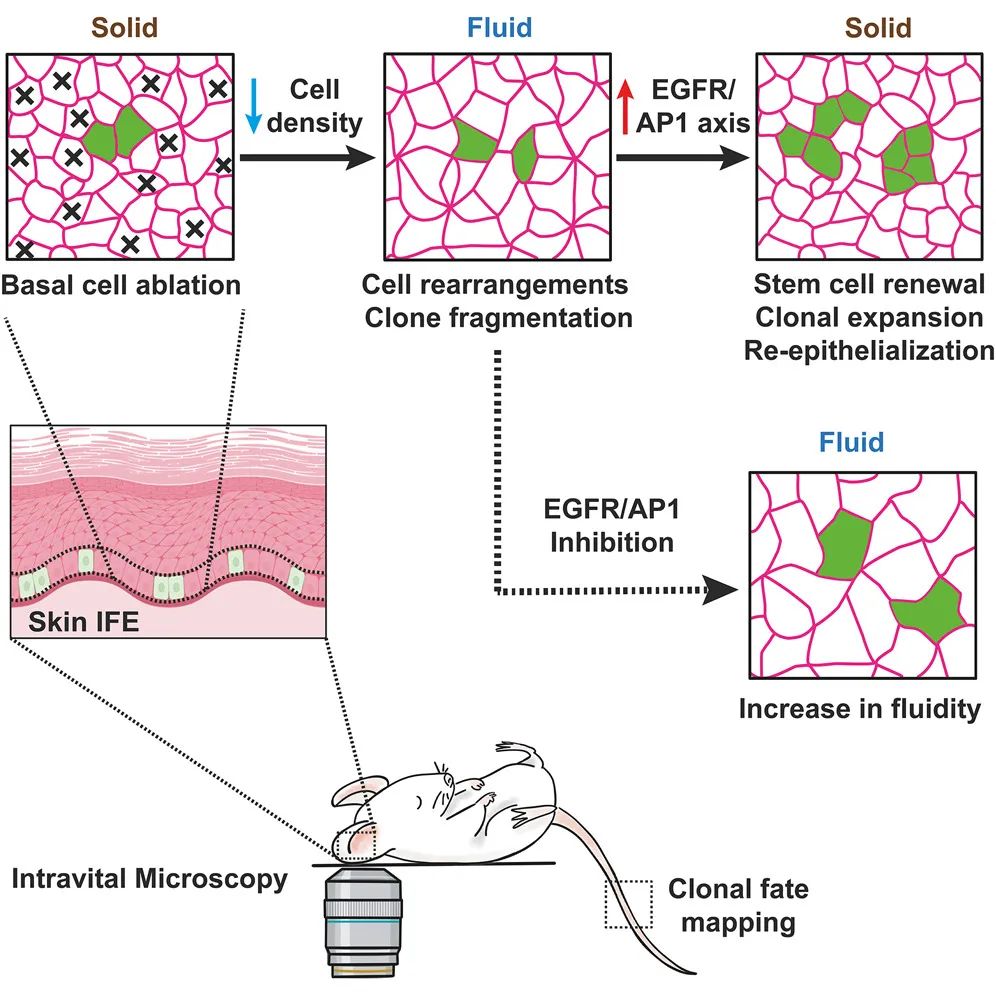
总而言之,这项发表于 Cell 的研究开发了一种基因小鼠模型,通过单细胞RNA测序、表观遗传分析以及功能实验,确定了伤口愈合过程中组织流动性的动态调节,并揭示了不同表皮干细胞中常见的再生细胞状态,该状态由EGFR/MEK/AP1信号轴调节,这一信号轴控制组织流动性和表皮再生。这些发现将指导皮肤损伤后的干细胞激活和组织修复的治疗方法的开发。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


