Nature Metabolism:ASS1通过代谢调节p53介导的DNA损伤反应,在DNA损伤中扮演关键角色
来源:生物谷原创 2024-07-29 09:45
实验结果表明,ASS1是一个代谢检查点,在DNA损伤后,它通过限制核苷酸合成和p53相关基因转录来阻断细胞周期进程,从而实现基因组的维持和存活。
尿素循环是哺乳动物的主要代谢途径,精氨酸琥珀酸合成酶ASS1将天冬氨酸和瓜氨酸结合形成精氨琥珀酸,后者被精氨酸裂解酶ASL分解形成鸟氨酸和尿素。ASS1还与ASL在细胞质中参与精氨酸-瓜氨酸循环,以供应细胞所需的精氨酸及其下游代谢物和富马酸。此前的研究发现,ASS1在许多癌症类型中被沉默,其表达降低影响了嘧啶核苷酸的平衡,进而促进了癌症增殖。此外,有研究发现,ASS1的启动子区域内存在p53结合位点,在X射线或阿霉素(DOX)诱导DNA损伤后,p53诱导ASS1基因表达上调。上述现象表明,ASS1与p53介导的DNA损伤之间存在联系。
近日,以色利魏茨曼科学研究所的Ayelet Erez团队在Nature Metabolism发表了题为ASS1 metabolically contributes to the nuclear and cytosolic p53-mediated DNA damage response的研究性论文,揭示了ASS1在DNA损伤中的关键作用。

为探究ASS1在p53介导的DNA损伤反应中的潜在作用,研究人员在携带野生型p53的结肠癌细胞中使用多柔比星(Dox)诱导DNA损伤。结果显示,Dox处理后,ASS1表达显著增加,与p53蛋白上调相一致。ASS1上调降低了DNA损伤后的天冬氨酸水平,阻碍了核苷酸的合成并暂停了细胞周期进程。
为了进一步表征ASS1的细胞效应,研究人员在Dox处理后进行了ASS1免疫荧光染色。结果显示,尽管ASS1是一个已知的细胞质酶,但在未经处理的结肠癌细胞中观察到了ASS1的核表达,并且其表达在Dox处理后显著增加。通过对结肠癌细胞进行细胞质和核部分分离,研究人员证实了Dox处理后ASS1和p53在核中的积累。接着,研究人员通过质谱鉴定到了ASS1与入核蛋白IPO7存在相互作用。免疫沉淀和邻位连接测定发现,DNA损伤增强了ASS1和IPO7之间的相互作用,促进了ASS1在细胞核中的存在。
鉴于ASS1产生精氨酸和富马酸盐需有ASL参与,研究人员对ASL的细胞核表达进行了探索,结肠癌细胞中ASL的核和胞质水平在Dox诱导的DNA损伤后增加,ASS1-ASL介导的细胞核内富马酸生成增加了DNA损伤后的存活率。
为了进一步破译ASS1在细胞核中的作用,我们对结肠癌细胞中的核部分进行了沉淀-质谱分析,发现了ASS1与几种与染色质重塑相关的蛋白质的相互作用。其中,与染色质亚家族C成员1(SMARCC1)的相互作用在Dox处理后增加,并随着ASS1丢失而减少。SMARCC1通过琥珀化调节染色质的可及性,而琥珀化是一种依赖于富马酸盐的翻译后修饰。在没有ASS1的细胞中进行Dox处理会导致SMARCC1琥珀化和SMARCC1蛋白水平降低,表明核ASS1是DNA损伤后的核蛋白琥珀化所必需的,特别是SMARCC1琥珀化。
RNA测序分析表明,ASS1缺失后,许多基因的转录增加,尤其是与p53和细胞周期调控相关的基因。ATAC测序分析表明,这些p53相关DNA损伤反应基因的启动子可及性在ASS1敲除细胞中受到的影响较小,表明ASS1对于限制几种p53调控基因的转录是必需的。
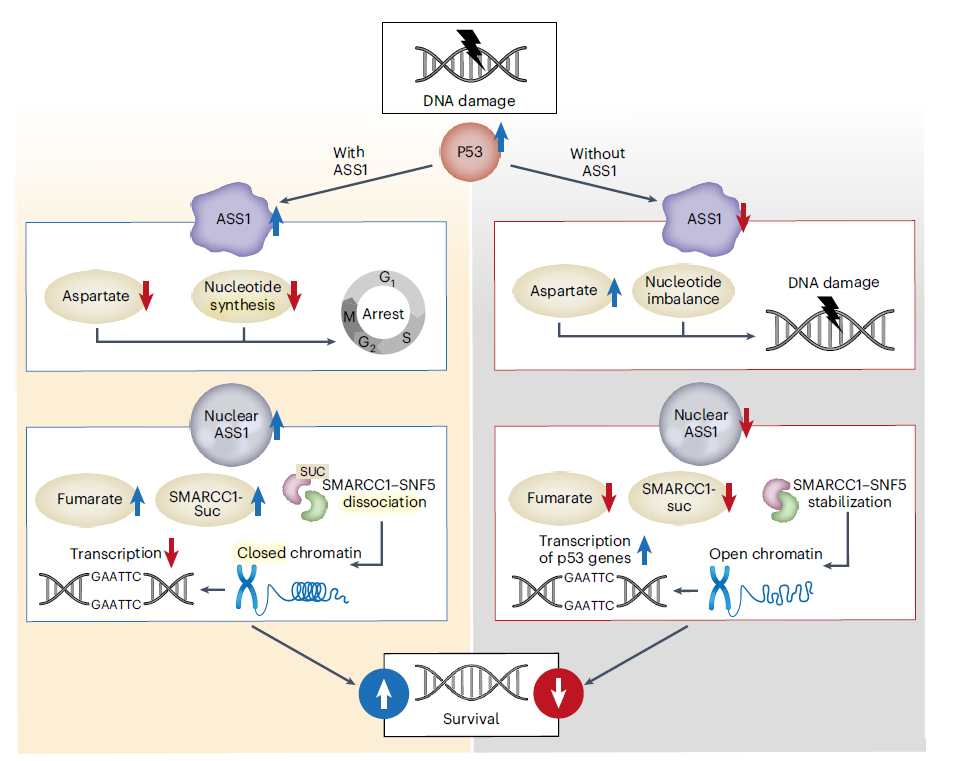
图:ASS1在p53介导的DNA损伤反应中的作用
总之,上述实验结果表明,ASS1是一个代谢检查点,在DNA损伤后,它通过限制核苷酸合成和p53相关基因转录来阻断细胞周期进程,从而实现基因组的维持和存活。ASS1缺失则会导致DNA损伤并加快细胞周期进程,进而引发导致癌症突变。(生物谷Bioon.com)
参考文献:
Lim, L.Q.J., Adler, L., Hajaj, E. et al. ASS1 metabolically contributes to the nuclear and cytosolic p53-mediated DNA damage response. Nat Metab 6, 1294–1309 (2024). https://doi.org/10.1038/s42255-024-01060-5
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


