JCI:一种双管齐下的新方法可增强免疫系统靶向消灭癌细胞的能力
来源:生物谷原创 2024-06-10 11:32
这项新的研究着重关注于一种名为“过继细胞转移”的免疫疗法,它涉及从病人体内提取T细胞,增强它们的抗癌能力,在培养基中扩增T细胞,并将它们重新注入病人体内。
在一项新的研究中,来自路德维格癌症研究中心的研究人员开发出了一种新型免疫疗法,它采用双管齐下的方法来攻击实体瘤,以增强免疫系统靶向和消灭癌细胞的能力。相关研究结果发表在Journal of Clinical Investigation期刊上,论文标题为“Combining SiRPα decoy–coengineered T cells and antibodies augments macrophage-mediated phagocytosis of tumor cells”。
这项新的研究着重关注于一种名为“过继细胞转移(adoptive cell transfer, ACT)”的免疫疗法,它涉及从病人体内提取T细胞,增强它们的抗癌能力,在培养基中扩增T细胞,并将它们重新注入病人体内。
领导这项研究的路德维格癌症研究中心研究员Melita Irving说,“虽然T细胞疗法在治疗某些血癌方面取得了巨大成功,但由于肿瘤微环境中的免疫抑制机制,对实体瘤的治疗带来了更复杂的挑战。仅靠T细胞可能还不够,这就是为什么我们正在探索通过整合其他免疫增强策略来提高T细胞有效性的方法。”
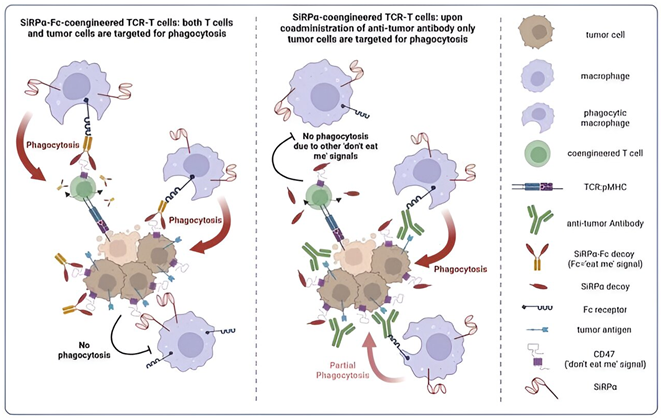
在这项新的研究中,Irving和她的团队改造了T细胞,使其分泌CV1,即人类蛋白SiRPα的高亲和力版本。
SiRPα通常与CD47相互作用,其中CD47是一种存在于健康细胞表面上的蛋白,它传递一种“别吃我”的信号,以防止巨噬细胞吞噬它们。然而,许多癌细胞利用这一系统,过度表达CD47,以避免被吞噬。
图片来自Journal of Clinical Investigation, 2024, doi:10.1172/JCI161660
Irving解释说,“先天性免疫系统,尤其是可以吞噬肿瘤细胞的巨噬细胞,对我们抗击癌症的免疫防御至关重要。”(T细胞属于免疫系统的另一个分支,即适应性免疫系统)。
Irving团队之前开发的 CV1 诱饵能以高亲和力结合 CD47,有效抑制这种“别吃我”的信号。据预计这将提高对癌细胞的可识别性,使其更容易受到巨噬细胞的攻击,与此同时,癌细胞也会成为这些经过改造的T 细胞的攻击目标;这些经过改造的T 细胞除了分泌CV1之外,还会表达亲和力优化的 T 细胞受体 (TCR)。
然而,Irving团队遇到了一个意想不到的问题。他们设计的 T 细胞分泌的 CV1 包括一个 Fc 尾部,Fc 尾部通常位于抗体分子的尾端,是吸引巨噬细胞攻击的标签。由于该标签如今包覆在分泌工程化 CV1 的 T 细胞上,这招致了巨噬细胞对这些治疗性T 细胞的全面攻击,导致递送到小鼠体内的 T 细胞耗竭。
为了改变这种情况,论文第一作者、Irving团队博士生Evangelos Stefanidis改造了T细胞,使其只表达没有Fc 尾部的CV1。这样,改造后的 T 细胞就不会遭受人类巨噬细胞的靶向攻击。
此外,将这些能产生CV1的T细胞与阿维鲁单抗(avelumab)和西妥昔单抗(cetuximab)等癌症靶向抗体结合,还能进一步提高巨噬细胞吞噬肿瘤细胞的能力。这是因为这些抗体,分别靶向免疫抑制性PD-L1分子和促进生长的表皮生长因子受体(EGFR)——具有活性Fc尾部,能吸引巨噬细胞特异性地攻击肿瘤细胞。Irving团队还观察到,用这些抗体治疗小鼠能有效改变肿瘤微环境,支持免疫攻击。
Irving解释说,“通过移除Fc尾部,我们可以使T细胞免受人类巨噬细胞的攻击,而通过将这些经过改造的T细胞与含有活性Fc尾部的临床抗体结合,我们可以有针对性地增强巨噬细胞对肿瘤细胞的吞噬作用。”
这些发现可能还有助于解释为什么抗体药物莫洛利单抗(magrolimab)的临床试验面临重大挑战,包括患者反应不佳和感染。与CV1诱饵一样,莫洛利单抗也能阻断肿瘤细胞表面上的CD47“别吃我”信号,从而促进免疫系统摧毁肿瘤细胞。但是,如果像带有 Fc 尾部的 CV1 诱饵一样,它的阻断作用并不完全针对癌细胞,那么它可能会引起健康组织的破坏。
Irving说,“莫洛利单抗也有可能靶向包括T细胞在内的免疫细胞,使之受到吞噬。我们的联合治疗策略有助于引导专门针对肿瘤细胞的吞噬作用,同时保护我们的经过改造的T细胞。我们的研究结果还凸显了癌症治疗的复杂性,以及采用细致入微的免疫疗法的重要性。”(生物谷Bioon.com)
参考资料:
Evangelos Stefanidis et al. Combining SiRPα decoy–coengineered T cells and antibodies augments macrophage-mediated phagocytosis of tumor cells. Journal of Clinical Investigation, 2024, doi:10.1172/JCI161660.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


