ADC的变革与未来
来源:医药魔方 2023-03-23 10:31
自首个抗体偶联药物(ADC)吉妥珠单抗奥唑米星(Mylotarg)上市以来,ADC药物跌跌撞撞走过了20多个年头,终于迎来了属于自己的高光时刻。特别是近几年,创新性ADC密集上市,以德曲妥珠单抗(T-
自首个抗体偶联药物(ADC)吉妥珠单抗奥唑米星(Mylotarg)上市以来,ADC药物跌跌撞撞走过了20多个年头,终于迎来了属于自己的高光时刻。特别是近几年,创新性ADC密集上市,以德曲妥珠单抗(T-DXd,DS-8201)、戈沙妥珠单抗为代表的ADC产品更是带火了整个领域的交易与合作,也推动了ADC市场规模的高速增长。
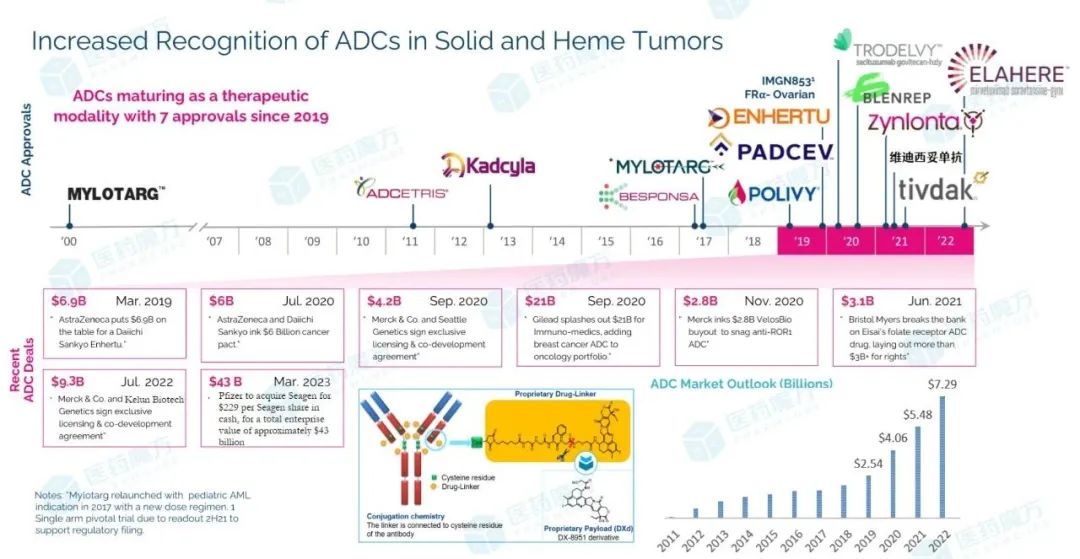
2月24日,国家药品监督管理局正式公告注射用德曲妥珠单抗(优赫得®)获批上市,适用于单药治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌。这也预示着,德曲妥珠单抗正式拉开国内临床变革序幕。

ADC作为时下最火热的赛道,吸引辉瑞豪掷约430亿美元加强产品布局。然而,ADC药物的未来究竟如何、还将引领哪些临床变革?在ADC浪潮中,特别是德曲妥珠单抗上市之后,ADC的创新方向会不会发生改变?未来,中国创新药模式下的突破之路该如何走?都在等待给出答案。
ADC源起:始于差异、终于不同
目前,全球共计约有650余款活跃状态的传统ADC药物,仅14款产品获批上市,仍有近200余款产品处于不同的临床研究阶段。其中,HER2 ADC占比依旧最高。因此,作为HER2 ADC的杰出代表,德曲妥珠单抗的成功或将改变ADC领域的开发格局与产品策略,最直接的变化已经体现在ADC药物的载荷选择。
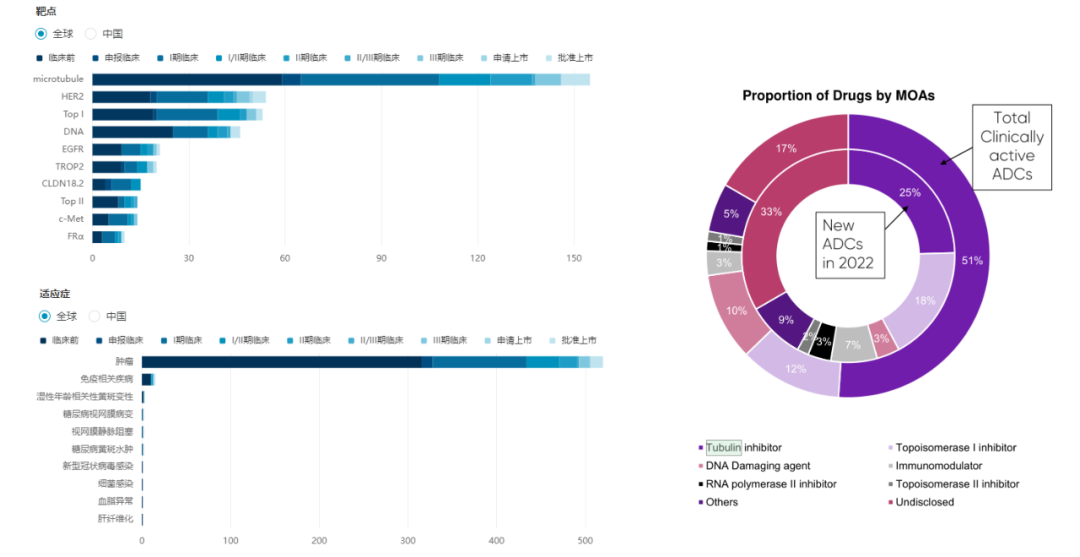
众所周知,ADC产品区别于化疗、靶向小分子和单抗药物,但也并非独身世外。ADC药物是由抗体(Antibody)、细胞毒性药物(Payloads,载荷)通过偶联物(Linker)桥接而成。机制上,普遍认为ADC药物中的抗体起着“导航”的作用,通过靶向肿瘤细胞表面特异表达的抗原精准地引导药物到达病灶,在肿瘤内部释放出具有高效治疗作用的细胞毒性药物,最终特异性杀伤肿瘤细胞。
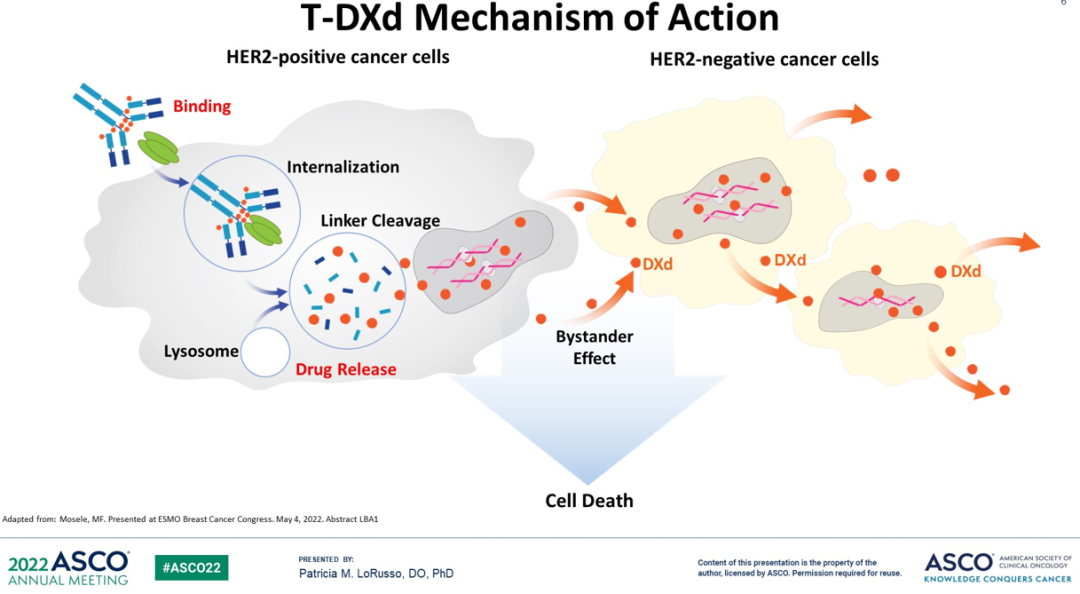
来源:2022 ASCO(LBA3 by Shanu Modi[1])
以德曲妥珠单抗为例,药物中的抗体(曲妥珠单抗类似物)结合肿瘤细胞表面表达的抗原HER2,发生内吞后与溶酶体融合,通过溶酶体酶降解可裂解Linker释放细胞毒性药物(DXd)。同时,由于DXd具有细胞透过性,也可以对临近的HER2阴性肿瘤细胞实现杀伤作用(旁观者效应)。
当然,并不是所有ADC都是通过可裂解Linker链接,已上市的恩美曲妥珠单抗和宣布退市的Blenrep便是采用的不可裂解Linker。同样,也不是所有载荷都具有细胞透过性,如恩美曲妥珠单抗降解后的毒素 (lysine-MCC-DM1)便无法高效透过细胞膜。因此,也就出现了机制上的些许差异,但整体而言都是遵循上述机制历程。总的来说,目前业界对于ADC药物的作用机制已经形成相对统一的共识,但对ADC药物的认知或许有待商榷。
首先,基于对ADC作用机制的理解,普遍将ADC的临床价值归结于细胞毒性药物(载荷),甚至称其为“递送工具”,包括审评专家也曾公开表示ADC就是一种化疗药物。当然,这种认识存在其合理性,但不同的ADC药物在不同的临床应用场景下,恐怕也难说完全正确。
仍以德曲妥珠单抗为例。德曲妥珠单抗采用曲妥珠单抗类似物靶向HER2,但在DESTINY-Breast04研究中,德曲妥珠单抗被应用于Her2低表达乳腺癌患者,如果仅作为递送工具考虑显然不会开展这项研究,也就不会诞生Her2低表达乳腺癌的新疗法。此外,DESTINY-Breast09研究更是鲜明的例子,在该研究中德曲妥珠单抗与含曲妥珠单抗的标准疗法开启了一线治疗HER2阳性乳腺癌的头对头研究。曲妥珠单抗联合化疗在HER2阳性乳腺癌患者中的临床价值毋庸置疑,20余年来鲜有药物能够在头对头的研究中胜出,足见第一三共对德曲妥珠单抗确实有着不一样的思考。
其实,从临床治疗背景考虑,也存在ADC区别于化疗的假设。对未接受过曲妥珠单抗和/或帕妥珠单抗治疗的HER2阳性乳腺癌初治患者而言,含有曲妥珠单抗类似物的德曲妥珠单抗不会只是“递送工具”的角色,或将对临床结局产生叠加作用。加之ADC药物的靶向作用,又能避免或降低化疗药物全身暴露导致的安全性问题,增加了药物的耐受性。因此,从疗效和安全性考虑,ADC药物也差异于单抗+化疗的临床治疗模式。
其次,ADC药物仍在不断完善和发展。近年来,载荷也发生了多样性的变化,除细胞毒性药物外,免疫刺激分子、靶向小分子和蛋白降解分子等也是ADC药物的探索方向,将ADC直接定义为化疗药物难免偏颇。
总之,ADC在诞生之初便有着差异于化疗、靶向小分子和抗体的药物设计,这种特性也注定了各类药物临床机制的不同。同时,随着ADC技术的发展和药物认知的变化,更多差异化的产品将持续涌现,或将像德曲妥珠单抗那般继续带来疾病临床治疗范式的改变。
ADC变革:治疗格局的再演变
回顾肿瘤治疗的百年发展史,先后历经了三次革命,也引领了临床治疗的化疗时代、靶向治疗时代和免疫治疗时代的三次演变。甚至可以说,药物的变迁推动着每一次肿瘤治疗的革命演变,也让每一次革命进程极具药物特色。
化疗时代打破了仅有外科和放疗作为临床治疗的困境,开启了药物治疗癌症的探索。以紫杉醇、多西他赛、伊立替康、铂类药物等为代表的化疗药物有着广泛的适应症优势,开辟了药物联合手术和/或放疗临床实践,但化疗和放疗的全身暴露导致的安全性影响着肿瘤患者的生存质量。靶向治疗时代,绝大多数药物实现了特异性的靶向作用,降低了全身毒性,利妥昔单抗和伊马替尼分别作为抗体和小分子两类靶向药物的代表凸显了临床实力,开启了精准医学的临床实践,但遗憾的是精准靶向设计也限制了药物的适应症空间。免疫治疗时代,PD-1/L1抗体药物不仅让我们领略了免疫治疗优势,也让我们再次看到免疫治疗的泛肿瘤领域潜力,但也存在先天耐药或应答不足的缺陷。
ADC的药物时代,肿瘤治疗模式又会发生哪些改变?肿瘤治疗格局将如何演变?
当前,恐怕尚不能完全确定ADC药物对肿瘤治疗演变的最终影响,毕竟创新性的产品仍在不断出现。不过,就目前产品的临床表现而言,可以看到ADC药物正如化疗和免疫治疗那般先后填补临床治疗空白或重塑治疗标准,持续拓展疾病的治疗深度。同时,也不断实现跨肿瘤领域的临床突破,彰显ADC药物的治疗广度,这种潜质似乎也可以通过ADC药物的机制得到完美诠释。通过特异性靶向来降低化疗药物的全身暴露毒性,而携带的细胞毒性药物助力其具备了泛肿瘤资格。
显然,多数已上市的创新性ADC治疗产品均具有这类潜质,且以靶向HER2和TROP2的ADC产品更加令人瞩目。尤其德曲妥珠单抗,在HER2阳性乳腺癌患者中的头对头研究获得了更优于T-DM1的临床获益[2],毫无悬念将成为新的治疗标准,更是同类产品无法回避的挑战。纵观德曲妥珠单抗的临床研究布局也不难看出,德曲妥珠单抗囊括了HER2阳性乳腺癌的末线治疗、二线治疗、一线治疗和辅助与新辅助治疗,涵盖了疾病早期至晚期的全病程管理,彰显了对疾病治疗深度的持续影响。
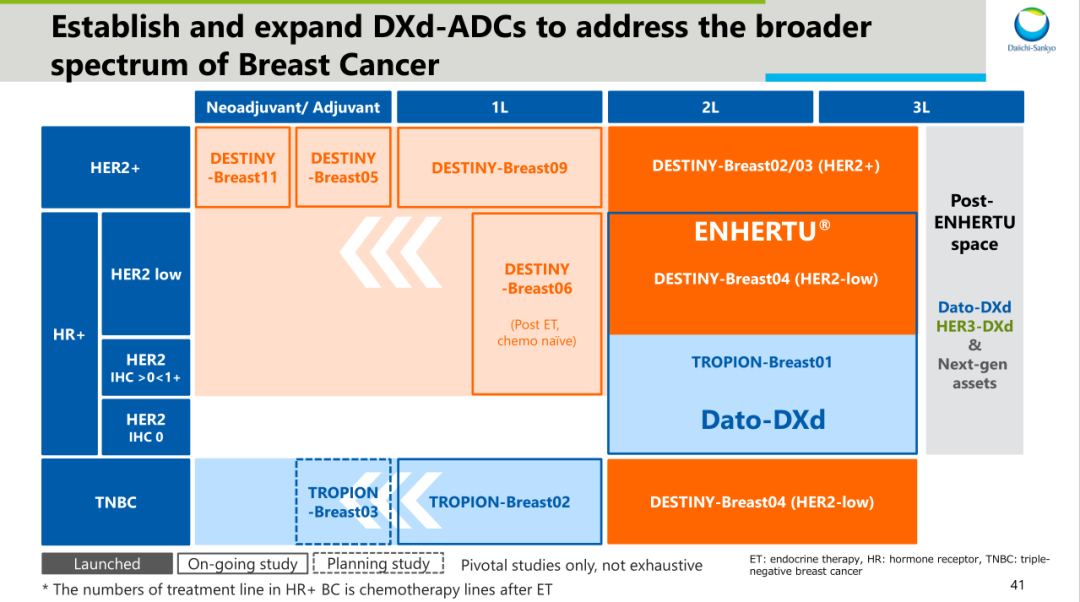
来源:第一三共研发日资料[3]
此外,德曲妥珠单抗已经具备的泛肿瘤潜力,更是药物治疗广度的力证。放眼全球,德曲妥珠单抗已经获批HER2阳性乳腺癌、HER2低表达乳腺癌、HER2阳性胃癌及胃食管交界处癌以及HER2突变非小细胞肺癌等适应症,尤其在HER2低表达乳腺癌和HER2突变非小细胞肺癌领域,德曲妥珠单抗都是全球首个获批的靶向治疗药物。
近日,德曲妥珠单抗的II期DESTINY-PanTumor02研究达到主要终点[4],该研究更是纳入包括了胆道癌、膀胱癌、宫颈癌、子宫内膜癌、卵巢癌、胰腺癌以及其他罕见癌症等肿瘤领域的晚期患者。TROP2 ADC同样如此,不仅颠覆了晚期TNBC治疗格局,也在尿路上皮癌、HR阳性乳腺癌中实现里程碑式进展。此外,针对非小细胞肺癌的探索也已经进入临床后期。
HER3 ADC更是在非小细胞肺癌、乳腺癌、结直肠癌和三阴性乳腺癌等多个肿瘤领域开展广泛探索。其中,HER3-DXd(patritumab deruxtecan)在刚刚结束的2023年日本临床肿瘤学会(JSMO2023)上公布的数据显示[5],对于接受过多线级治疗的EGFR突变局部晚期或转移性NSCLC患者,HER3-DXd经盲态独立中心审查(BICR)评估的ORR达到40.2%,中位总生存期接近16个月,特别是对于接受过第三代EGFR TKI和铂类治疗的患者,中位总生存期也达到16.2个月,再次彰显了ADC药物的临床变革潜力。
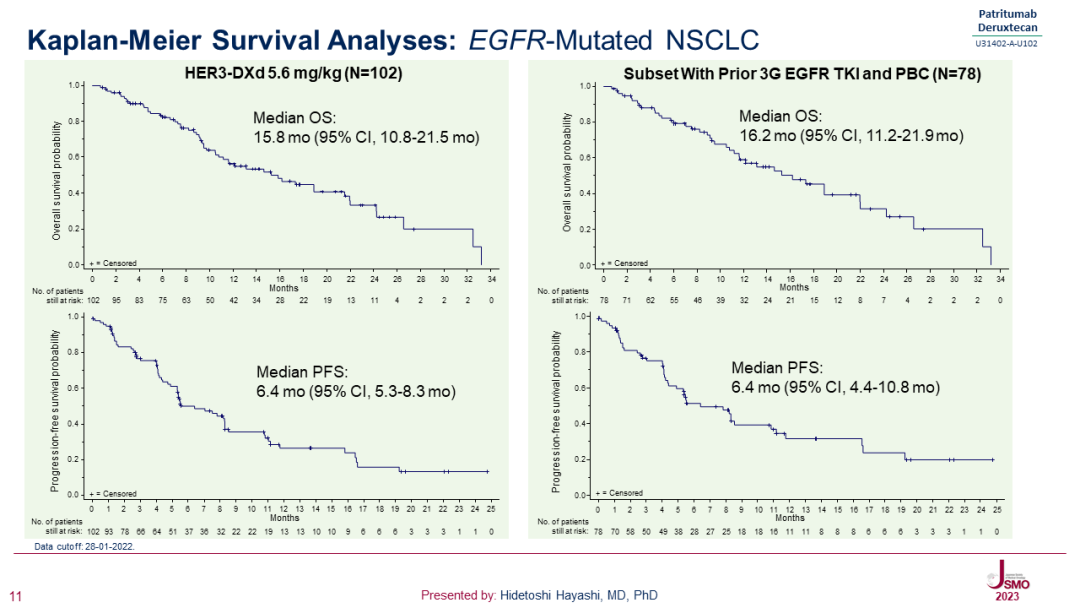
来源:JSMO2023(Presented by: Hidetoshi Hayashi, MD, PhD)
可以说,创新性的ADC产品正在以势不可当的气魄,改变着临床治疗规范,同时也影响了ADC产品的开发格局和策略。特别是《以临床价值为导向的抗肿瘤药物临床研发指导原则》实施之后,对临床研究的对照药物标准也给出了指导意见,明确提出以临床价值为导向的原则,要求创新药物相对于对照药物需体现临床优势。因此,在创新性ADC产品实现临床突破、转化为标准治疗之后,未来的临床需求如何演变、ADC药物如何开发也就成为下一代ADC产品需要直面的挑战。
ADC未来:走向何方?
1913年,著名的德国化学家保罗·埃利希(Paul Ehrlich)提出了“魔法子弹”概念[6],被认为是ADC药物的最早描述。2000年,FDA批准首个ADC药物Mylotarg上市,本以为ADC药物春天来临,却因为疗效不显著和脱靶毒性而退市,令ADC再次坠入黑暗之渊。
此后,随着抗体药物的发展、偶联技术的进步以及ADC概念的不断完善等多种因素,历经几代ADC药物的摸索与验证,终于迎来属于ADC的光辉时刻。当初的“魔法子弹”,也俨然升级成为了“魔法导弹”。
事实上也的确如此,ADC药物的靶向作用扩大了传统化疗的治疗窗口,令ADC具备了携带更高细胞毒性载荷的可能。戈沙妥珠单抗携带的载荷SN-38是原药伊立替康活性的100倍以上[7],而德曲妥珠单抗携带的DXd约是SN-38活性的9倍之多[8]。同时,得益于靶向作用又能高浓度地释放于肿瘤细胞周围,甚至发挥旁观者效应杀伤临近肿瘤细胞,实现“1+1>2”的协同作用。

各类有效载荷近似细胞毒性范围[9]
然而,如何平衡疗效和安全性一直是开发ADC药物的挑战,也是制约ADC药物发展的瓶颈。
面对德曲妥珠单抗不断带来的临床冲击,理论上存在安全性潜质的ADC药物却因担心竞争格局的影响而终止开发。首个靶向BCMA的ADC疗法Blenrep因确证性临床研究疗效欠佳,成为第二个经历撤市风波的ADC药物。这些现象再次佐证,创新药物的迭代发展从来都不会是一路坦途。
因此,有魄力和勇气直面下一代ADC药物开发挑战的药企,或有资格决定未来的ADC模样。第一三共潜心笃志、砥身砺行,历经10年匠心打造DXd技术平台,如今一朝功成不仅塑造了德曲妥珠单抗的成功典范,也完成了DXd技术平台的验证,更是吸引到阿斯利康这样的肿瘤优势MNC关注,共同开发和推广包括德曲妥珠单抗在内的两款DXd技术产品。而在德曲妥珠单抗之后,第一三共已经提出了“next-generation/new-concept ADCs”的设想,更令业界对此充满了期待。
当然,为突破ADC药物的发展桎梏,不同的企业都在尝试给出自己的创新答案。概况来讲,主要是基于ADC药物的组成分别进行开拓性探索。抗体部分,目前主流的理论仍是以避免靶向正常细胞而探索肿瘤特异性高表达抗原,但也有企业正在尝试Probody理念,通过抗体的肿瘤特异性靶向激活而实现选择性,此举有望提高ADC药物的潜力并扩大抗原的选择空间。
Linker和载荷部分主要集中在解决循环中提前释放导致的毒性问题,包括采用定点偶联、非天然氨基酸偶联、点击化学等技术形成更稳固的共价偶联,避免抗体与Linker的脱离。其次,载荷同样也有Probody理念的设计尝试,凭借β-葡萄糖醛酸酶敏感接头、成纤维细胞活化蛋白酶裂解等实现肿瘤环境的特异性释放。此外,免疫激活、蛋白降解等创新性新机制的载荷也是探索的新领地,更有双机制的ADC设计理念。
同时,对ADC的认识和认知也在不断进步,ADC药物载荷在肿瘤细胞胞外释放也并非毫无可能。不过,这些创新探索仍处于早期研究,未来ADC赛道更多的技术创新和理念有待临床的概念验证。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


