Nature:罕见基因变异如何引发阿尔茨海默病?科学家发现关键机制及潜在疗法
来源:生物谷原创 2025-09-15 09:58
来自麻省理工学院等机构的科学家们通过研究揭示了罕见基因变异如何导致阿尔茨海默病,为治疗这一疾病带来了新的希望。
阿尔茨海默病(AD,Alzheimer's disease)是全球最常见的神经退行性疾病之一,给无数患者及其家庭带来了沉重的负担,WHO数据显示,全球约有5000万人患有阿尔茨海默病,预计到2050年,这一数字将翻倍。尽管科学家们对阿尔茨海默病的研究已经持续了数十年,但其确切病因仍然不完全清楚。
最近,一篇发表在国际杂志Nature上题为“ABCA7 variants impact phosphatidylcholine and mitochondria in neurons”的研究报告中,来自麻省理工学院等机构的科学家们通过研究揭示了罕见基因变异如何导致阿尔茨海默病,为治疗这一疾病带来了新的希望。
文章中,研究人员聚焦于一种名为ABCA7的基因,该基因的功能性变异在人群中极为罕见,但携带这些变异的人患阿尔茨海默病的风险却显著增加,ABCA7基因能编码一种脂质转运蛋白,负责将脂质运输穿过细胞膜。脂质代谢在细胞功能中起着关键作用,尤其是在细胞膜的形成和维持中,此前研究已经发现,另一种更常见的阿尔茨海默病风险因素—APOE4基因也主要会影响脂质的代谢。
通过单细胞RNA测序分析人类大脑样本,研究人员发现,与罕见ABCA7功能丧失变异相关的多种神经细胞类型中存在广泛的基因表达变化,表达ABCA7水平最高的兴奋性神经元显示出脂质代谢、线粒体功能、DNA修复和突触信号传导途径的破坏,这些基因表达的变化与神经元的过度兴奋和细胞应激状态有关,或许会导致DNA和其它细胞成分的损伤。
研究者指出,这些变异细胞的线粒体功能会受损、氧化应激增加且磷脂酰胆碱代谢紊乱。线粒体是细胞的能量工厂,其功能障碍会导致细胞内能量供应不足进而影响细胞的正常功能;氧化应激则是指细胞内自由基过多从而导致细胞损伤。磷脂酰胆碱是细胞膜的重要组成部分,其代谢紊乱可能导致细胞膜的结构和功能异常。
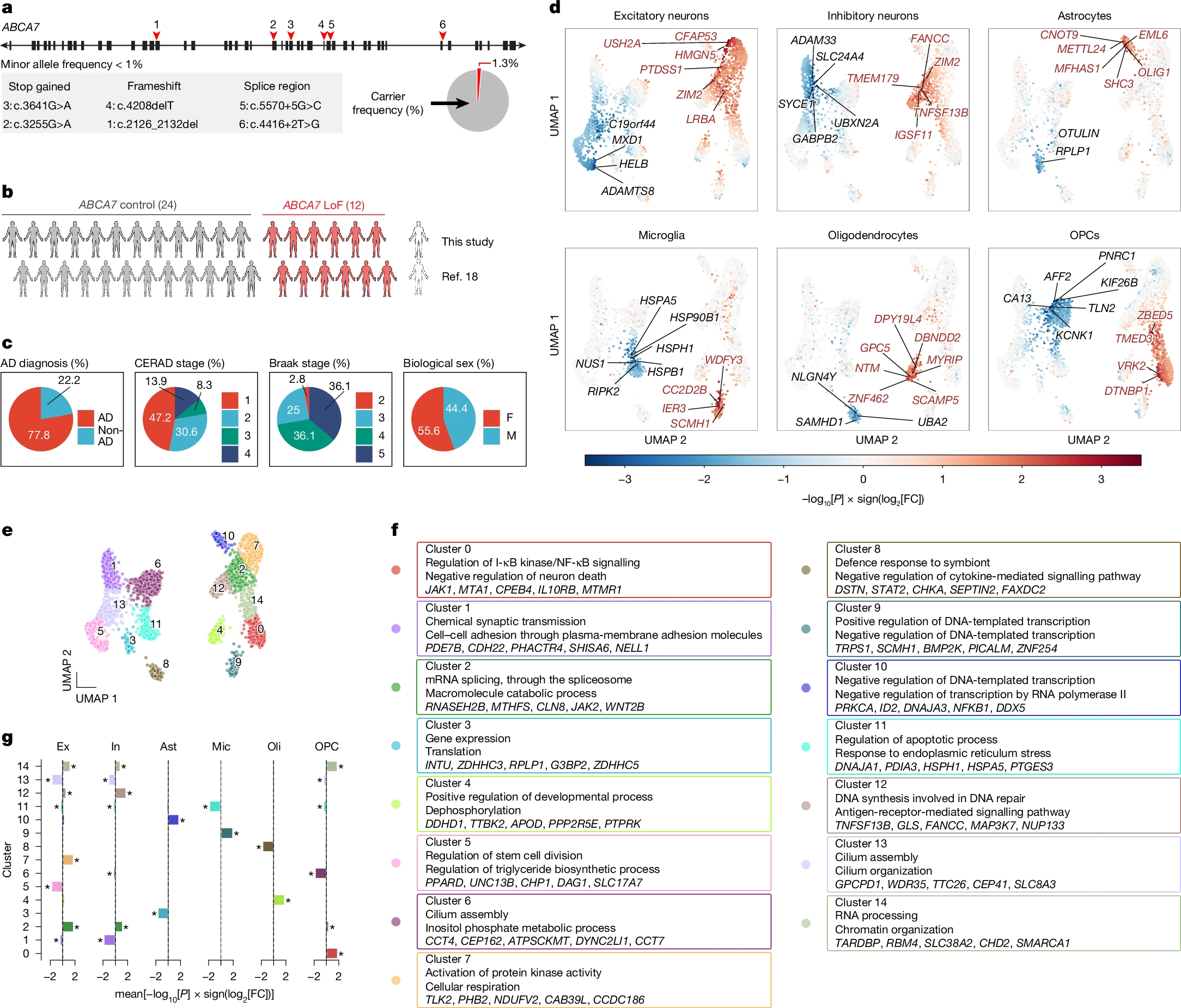
ABCA7功能缺失突变体携带者死亡后大脑中前额叶皮质的snRNA序列图谱
研究人员尝试通过补充CDP-胆碱(磷脂酰胆碱的前体)来纠正这些异常;结果显示,补充CDP-胆碱可以增加磷脂酰胆碱的合成从而逆转这些异常,并使淀粉样β分泌和神经元过度兴奋恢复正常。淀粉样β蛋白的积累是阿尔茨海默病的一个关键特征,而神经元的过度兴奋则可能会导致神经网络的异常活动并进一步加重疾病进展。
研究者指出,当用胆碱处理这些细胞时,许多转录缺陷得到了逆转,他们还发现,失去ABCA7的神经元中观察到的过度兴奋表型和淀粉样β肽水平升高在治疗后有所降低。这项研究不仅揭示了ABCA7基因变异如何通过破坏脂质代谢来增加阿尔茨海默病的风险,还为开发新的治疗方法提供了可能;通过补充CDP-胆碱就能纠正这些细胞的异常状态,为开发基于胆碱补充的疗法或能提供一定的理论基础。
Li-Huei Tsai教授指出,从APOE4到ABCA7功能丧失,我们证明了脂质稳态的破坏会导致阿尔茨海默病相关病理的发展,而通过胆碱补充恢复脂质稳态就能改善这些病理表型。此外,研究人员还发现,除了罕见的ABCA7变异外,还有一种更常见的变异,其在人群中的频率约为18%,此前认为这种变异是无害的,但研究者发现,携带这种变异的细胞也囧表现出与罕见变异相似的脂质代谢基因改变。
尽管后期科学家们还需要进一步研究,但目前的研究结果表明,ABCA7的功能障碍可能在更广泛的人群中发挥重要作用,而不仅仅是携带罕见变异的人。(生物谷Bioon.com)
参考文献:
von Maydell, D., Wright, S.E., Pao, PC. et al. ABCA7 variants impact phosphatidylcholine and mitochondria in neurons. Nature (2025). doi:10.1038/s41586-025-09520-y
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


