Nature Communications: 间充质胶质瘤干细胞可以刺激血管再生
来源:生物谷原创 2024-04-21 10:14
本研究观察结果表明,血管扩张是一个可靶向的过程,通过EGFR失活,并可能通过干扰其内皮介质和EV载体。
多形性胶质母细胞瘤(GBM)是原发性星形细胞性脑肿瘤中最常见和最致命的形式,与血管丰富和异质性相关。GBM“生长单位”由胶质瘤干细胞(GSCs)组成,其转录组的范围从前膜细胞(PN)到间质细胞(MES),使人想起相应的GBM亚型。这些特征源于分化程序的叠加和致癌突变的潜在影响。
在这方面,典型的是表皮生长因子受体(EGFR)的扩增及其激活截断产生一种变体(EGFRvIII),影响肿瘤发生的内在和非细胞自主方面。值得注意的是,EGFR/EGFRvIII通常在mes - gsc中表达,而在PN-GSC中则不表达,这是一种二分法,其生物学后果尚不清楚。
由GSCs引发的肿瘤发生在复杂的组织微环境中,包括血管周围和实质壁龛。相反,GSCs被认为具有增强的促血管生成活性,包括血管内皮生长因子(VEGF)的产生升高,以及伴随GBM进展的病理性血管生长和畸形的其他影响。
虽然靶向治疗VEGF血管生成途径在GBM患者中产生了明显的血管反应,但它并没有提高生存率。这些令人惊讶的结果表明,目前对GBM新生血管机制及其介质的理解仍存在差距。

图片来源:https://doi.org/10.1038/s41467-024-46597-x
近日,来自麦吉尔大学健康中心研究所的研究者们在Nature Communications杂志上发表了题为“Mesenchymal glioma stem cells trigger vasectasia—distinct neovascularization process stimulated by extracellular vesicles carrying EGFR”的文章,该研究揭示了间充质胶质瘤干细胞通过携带EGFR的细胞外囊泡刺激血管扩张是一种独特的新生血管过程。
胶质母细胞瘤(GBM)的靶向新生血管形成由于对其潜在机制的了解不足以及与肿瘤分子景观的不明确联系而受到阻碍。在本研究中,研究者报告了不同分子亚型的人胶质瘤干细胞(GSC)引发不同的内皮反应,包括血管生成或血管扩张。
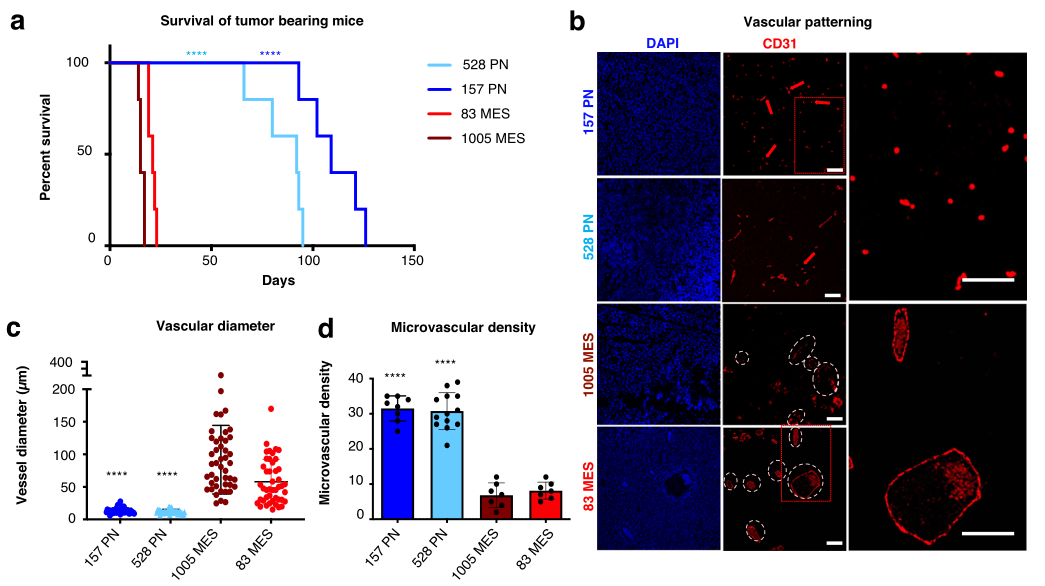
神经胶质瘤驱动肿瘤的不同血管模式和胶质瘤干细胞分泌组可溶性和泡状成分的血管活性
图片来源:https://doi.org/10.1038/s41467-024-46597-x
后一过程由间充质(而非原膜)GSCs选择性触发,并由能够将EGFR/EGFRvIII转录物转移到内皮细胞的细胞外囊泡(ev)亚群介导。通过抑制EGFR的表达和ph,无论是在药理学上(Dacomitinib)还是在遗传学上(基因编辑),都可以消除它们在体外的EV反应,并破坏体内的输精管扩张。
在小鼠中,治疗性抑制EGFR显著延长了VEGF阻断的抗癌作用,同时消除了血管扩张,延长了生存期。因此,由癌性EGFR的细胞间转移驱动的血管扩张可能代表了GBMs子集的一个新的治疗靶点。
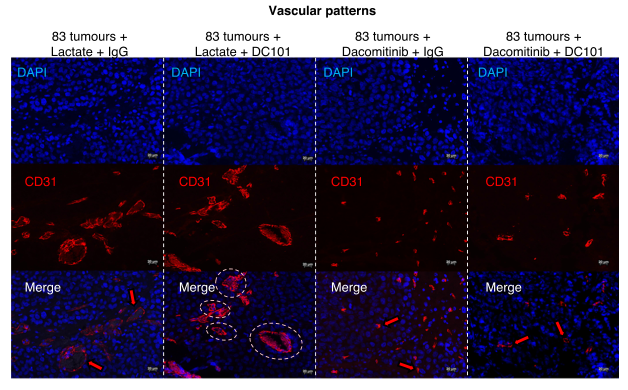
联合靶向VEGFR2和EGFR抑制肿瘤生长和输精管扩张
图片来源:https://doi.org/10.1038/s41467-024-46597-x
总之,本研究观察结果表明,血管扩张是一个可靶向的过程,通过EGFR失活,并可能通过干扰其内皮介质和EV载体。有趣的是,EGFR靶向似乎能够克服(至少部分地)异种胶质母细胞瘤对vegf驱动的血管生成抑制的获得性抵抗。
但最重要的是GBM的区域异质性和微环境复杂性,以及应激因素,如缺氧和治疗是输精管扩张的重要背景。研究者认为,更好地了解GBM微环境中ev介导的过程可能会导致这种令人沮丧的疾病的新形式的精确治疗。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


