Cell:揭示神经元树突中的‘信息高速公路’,周期性ER-PM连接点的新发现
来源:生物探索 2024-12-27 15:41
ER-PM连接点的研究为解锁神经网络的更多奥秘点亮了一盏明灯。
在神经科学领域,神经元的树突(dendrite)被认为是处理信息的核心结构之一,其能够通过复杂的电生理和分子机制整合并传递来自多个突触的输入。然而,关于树突如何在细胞内部实现信号的长距离传播,特别是涉及钙离子(Ca²⁺)信号的整合,研究人员长期以来未能揭示其细致的机制。
12月20日Cell的研究报道“Periodic ER-plasma membrane junctions support long-range Ca2+ signal integration in dendrites”,研究人员发现了一种周期性分布的内质网-质膜(ER-PM)连接结构,这些连接被形象地描述为“梯状”分布,并在树突中以约1微米的间隔排列。这一新发现的亚细胞结构不仅提供了钙信号传输的物理基础,还可能通过协调局部和长距离的信号传递,显著影响树突的生物化学活动。
研究团队通过高分辨率成像技术,例如多色超分辨显微镜和聚焦离子束扫描电子显微镜(FIB-SEM),详细解析了这种结构的形态及其功能特性。他们发现,这些ER-PM连接点作为钙离子流入和释放的枢纽,富集了关键的分子机器,包括内质网钙释放通道(如Ryanodine受体,RyRs)和质膜钙通道(如CaV家族)。更重要的是,这些连接点还支持钙/钙调蛋白依赖的蛋白激酶II(CaMKII)的局部激活,进一步揭示了其在神经信号传递中的关键作用。
通过该研究,研究人员首次阐明了树突内的一种精密钙信号调控机制。这不仅深化了我们对神经元内质网功能的理解,也为探索突触信号如何被远距离传递提供了重要线索。这一发现或将改变我们对脑功能和突触可塑性的认识,同时也为开发治疗相关神经疾病的新策略奠定了基础。

树突:大脑中信息处理的核心枢纽
在浩瀚的神经网络中,树突(dendrite)如同一条条信息高速公路,承载着神经元接收和整合信号的重任。每个神经元的树突在结构上形似树枝,分布广泛、细致入微,其上的突触则如同树叶,接收来自其他神经元的电化学信号。这些输入信号在树突中被处理后,会影响神经元的整体输出,从而参与到大脑复杂的信息计算和记忆存储中。
研究人员长期以来关注树突的作用,不仅因为它在神经信号整合中的重要性,还因为它具备对不同时间和空间尺度的信号做出响应的能力。通过电压门控离子通道和配体门控离子通道,树突能够高效调节局部膜电位的变化。然而,信号传递的复杂性远不止于此。树突内还有一种关键的“语言”——钙离子(Ca²⁺),它在突触活性、可塑性和分子信号传递中起到至关重要的作用。
钙信号在树突中的传播方式极具挑战性。由于细胞内环境的高度分隔性,Ca²⁺信号通常仅局限在纳米级的范围内,这使得如何实现长距离的信号整合成为一个未解的科学难题。这一问题的重要性不言而喻,因为钙信号不仅影响单个突触的强度,还可能通过调控多个突触之间的协同作用,决定整个神经回路的运行。
有趣的是,最新的研究发现,树突内的内质网-质膜(ER-PM)连接点构建了一种“梯状”结构,为长距离信号传递提供了物理基础。这些周期性分布的连接点充当了钙信号的“中继站”,能够将局部刺激转化为全局的化学信号。
未解之谜:树突内信号的长距离传播如何实现?
为了回答这些问题,该研究聚焦于一种新发现的亚细胞结构——内质网-质膜(ER-PM)连接点。这些连接点在树突中以约1微米的间隔周期性分布,形成了“梯状”结构。研究显示,这些ER-PM连接点富含钙释放通道(如Ryanodine受体,RyRs)和钙流入通道(如CaV2.1和CaV2.2),能够在局部触发钙信号的释放,并将其放大和传播到更远的区域。而且,这种分布模式被发现不仅存在于哺乳动物神经元中,也出现在果蝇的中枢神经系统中,表明这种机制可能在进化中被高度保留。
通过这种特殊的结构,钙信号不再局限于局部,而是能够沿树突扩展到几十微米甚至更远的距离。
新发现:神经元中的“梯状”结构
周期性内质网-质膜(ER-PM)连接结构的发现为理解树突内的信号传播机制提供了全新的视角。研究表明,在哺乳动物和果蝇的神经元中,ER-PM连接点以约1微米的间隔均匀分布,沿着树突形成了一个类似梯子的网络。这种特殊的结构在不同类型的树突中都表现出高度一致性:在较粗的近端树突,其“横档”数量更多,而在较细的远端树突,结构则相对简单。
这些“梯状”连接点并不仅仅是静态的分隔带。研究显示,每一个ER-PM连接点都承载着丰富的分子机器,包括钙离子流入通道(如CaV2.1和CaV2.2)以及钙释放通道(如Ryanodine受体,RyRs)。通过这些通道,连接点能够在局部触发钙离子的流动,并通过“横档”之间的内质网相互连接,将信号进一步传播。高分辨率显微技术,如多色超分辨显微镜和聚焦离子束扫描电子显微镜(FIB-SEM),清晰展示了这些连接点的形态和分布,为研究人员揭示了这种精妙结构的存在。
而且,这种结构不仅在体外培养的神经元中被观察到,还存在于小鼠和果蝇等动物的大脑中。研究发现,在果蝇的大脑蘑菇体(mushroom body)神经元中,类似的“梯状”结构分布更加复杂,表明这一现象在不同物种间具有显著的保守性。
这一发现的重要性在于,它为解释树突内钙信号的长距离传播提供了物理基础。通过周期性分布的ER-PM连接点,树突内的信号可以像接力赛一样,从一个“横档”传递到下一个。这种机制如同一座“信息高速桥梁”,让每个突触的输入不仅仅影响局部,还能在更大范围内引发协同反应。
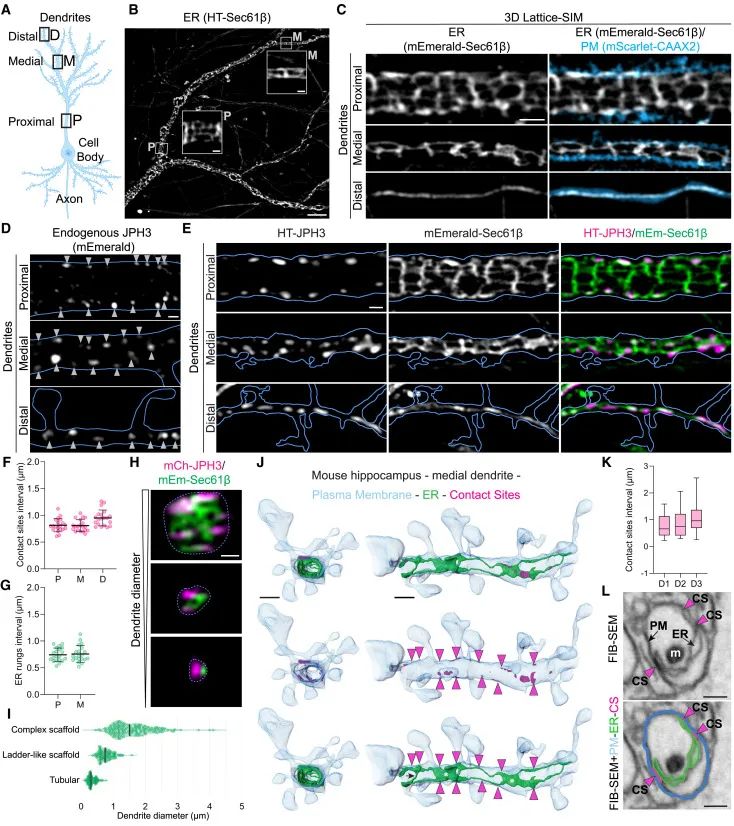
内质网-质膜(ER-PM)连接点在海马神经元树突中的周期性分布及其结构特征(Credit: Cell)
树突区域划分与直径范围
图(A) 通过示意图展示了海马神经元的不同树突区域,包括近端树突(直径为0.5–4.1 μm)、中段树突(直径为0.3–1.2 μm)以及远端树突(直径为0.1–0.76 μm)。这些区域的划分为后续研究提供了明确的空间定位参考。
内质网在树突中的“梯状”组织
图(B) 和 (C) 通过Lattice-SIM超分辨显微镜技术揭示了在培养21天的原代大鼠海马神经元树突中,内质网呈现出“梯状”的分布模式,尤其是在近端和中段树突区域。这些“横档”结构表现为内质网横向分支与质膜的接触点。
Junctophilin-3(JPH3)的分布模式
图(D) 和 (E) 显示了JPH3在树突中的内源性分布,标记显示这些蛋白聚集在质膜附近的特定位置,并与内质网的横向分支相连接,分布间隔约为0.8–1 μm。
ER-PM连接点的分布间隔
图(F) 和 (G) 提供了定量分析,显示在近端和中段树突区域,ER-PM连接点的平均间隔分别为0.82 ± 0.12 μm和0.81 ± 0.11 μm;内质网横向连接的平均间隔分别为0.74 ± 0.13 μm和0.76 ± 0.16 μm。这种高规律性的分布进一步证明了“梯状”结构的周期性。
树突直径与ER组织复杂性的关系
图(H) 和 (I) 展示了不同直径的树突中内质网的组织复杂性。较粗的近端树突内质网结构更为复杂,而较细的远端树突则呈现单一管状结构。这种变化与树
信号传递的枢纽:ER-PM连接点的功能揭秘
在神经元的树突中,周期性分布的内质网-质膜(ER-PM)连接点如同信号传递的“枢纽站”,其功能远超单纯的结构支撑。这些连接点不仅承载着钙离子(Ca²⁺)流动的关键机制,还在信号的局部放大与长距离传播中发挥核心作用。研究揭示,这些连接点通过紧密结合的分子机器,为树突内的信号整合和传播提供了强有力的支持。
每个ER-PM连接点都富含Ca²⁺流入和释放的核心蛋白。质膜上的电压门控钙通道(如CaV2.1和CaV2.2)能够感应突触活动带来的膜电位变化,将钙离子导入胞内;而内质网上的Ryanodine受体(RyRs)则作为钙释放通道,在局部刺激下触发内质网内储存的钙离子释放。这种双向作用使得ER-PM连接点成为钙信号传递的枢纽。
更为独特的是,这些连接点能够通过局部放大信号,促使钙信号传递至更远的距离。实验表明,当树突的某一突触受到局部刺激时,钙信号可以通过这些连接点,以20微米以上的距离传播到其他树突区域。这一过程依赖于“梯状”结构的分布特性,每个连接点通过内质网的横向延伸相互连接,将信号层层传递。这种模式被形象地比喻为“接力赛”,将局部活动转化为更大范围的化学信号响应。
此外,ER-PM连接点还支持钙依赖性分子机制的激活。例如,钙/钙调蛋白依赖的蛋白激酶II(CaMKII)在这些连接点被有效激活,从而进一步调控突触的可塑性。这些分子级的活动表明,ER-PM连接点不仅是钙信号的通道,更是其整合和调控的核心。
这种功能性的复杂性使得ER-PM连接点成为研究神经元信息处理的焦点。通过这些“枢纽站”,局部突触信号得以超越其物理限制,扩展到整个树突网络,展现了神经元对复杂信息的高效整合能力。
钙信号与CaMKII:分子机器的合作之舞
在神经元复杂的分子网络中,钙离子(Ca²⁺)与钙/钙调蛋白依赖的蛋白激酶II(CaMKII)之间的协作被形象地称为一场“合作之舞”。这种动态而精确的合作在周期性分布的内质网-质膜(ER-PM)连接点上得以完美展现,成为树突内信号调控的核心机制之一。
研究表明,钙信号在ER-PM连接点的触发是CaMKII活化的关键起点。质膜上的电压门控钙通道(如CaV2.1和CaV2.2)感应突触活动,将钙离子导入胞内,引发局部钙浓度的升高。同时,ER-PM连接点内的Ryanodine受体(RyRs)响应这种变化,释放内质网中储存的大量钙离子。由此形成的高浓度钙信号触发钙调蛋白与CaMKII的结合,使CaMKII进入活化状态。
活化后的CaMKII并不仅仅是一个信号的“执行者”,它具有高度的自我调节能力。通过自身的磷酸化作用,CaMKII能够维持其活化状态,即使钙浓度恢复到基线水平。这种持续性激活使其能够在更长时间内调控突触可塑性和神经元活动。CaMKII的功能涉及多个层面,包括调节突触的强度、促进长时程增强(LTP),以及参与学习和记忆的分子机制。
研究还揭示,CaMKII在ER-PM连接点的局部化和激活具有高度空间精确性。实验发现,钙信号的局部释放与CaMKII活化的热点在ER-PM连接点处高度重合,说明这些连接点不仅是钙信号的枢纽,也是CaMKII功能的主要平台。这种机制允许单个突触的活动对远距离树突区域产生生化影响,从而实现信号的空间整合。
这场“合作之舞”展现了钙信号与CaMKII之间复杂而精准的协作模式,它将突触的短暂活动转化为持久的分子反应,为神经元的信号传递和功能调控提供了生物学上的基础。
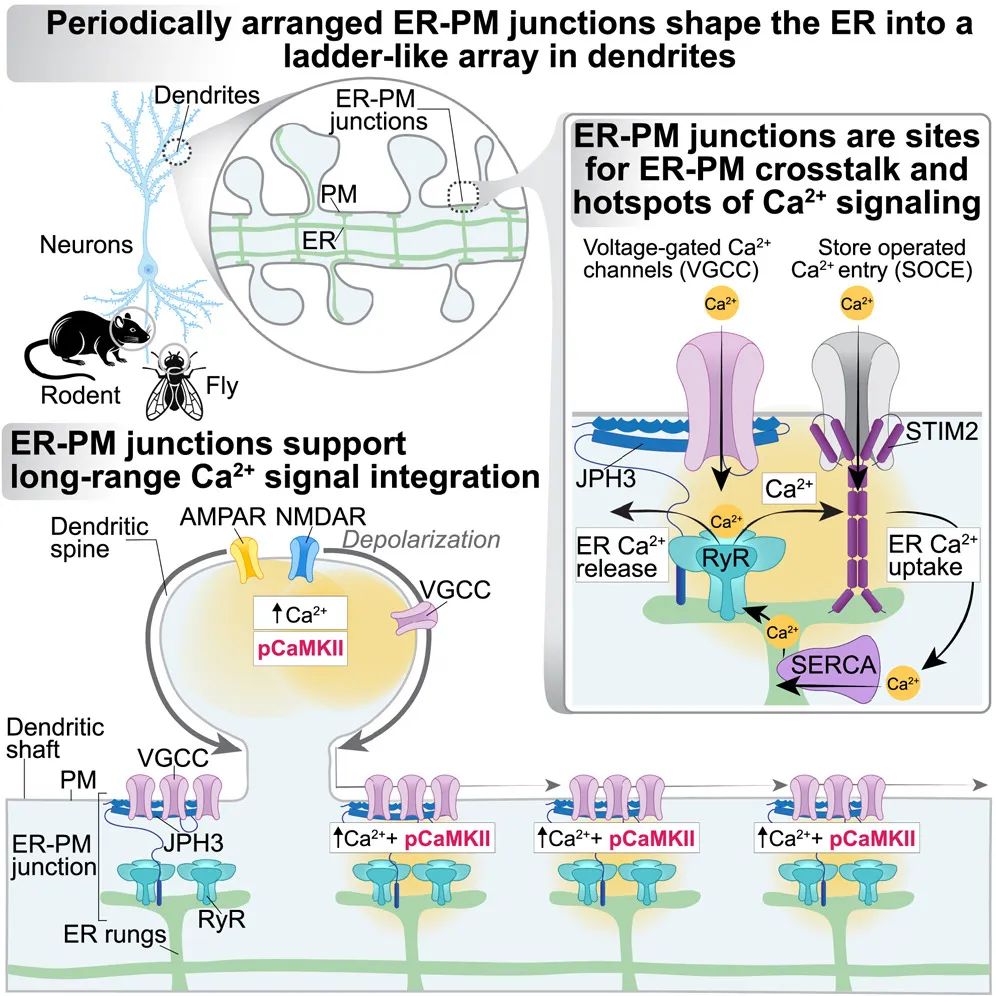
模式图(Credit: Cell)
从微观到宏观:这些结构如何影响树突的整体功能?
神经元的树突如同大脑中的“信息公路”,承载着复杂的信号处理任务。然而,这一过程不仅依赖突触处的局部活动,还需要将信号高效地传播到更远的区域,最终影响整个神经网络的运作。周期性内质网-质膜(ER-PM)连接点的发现,揭示了这种远距离信号传播的关键机制,并从微观结构的角度提供了令人信服的解释。
研究显示,ER-PM连接点通过其高度有序的分布,实现了信号的长距离传递。在树突中,这些连接点以约1微米的间隔排列,构成了一个跨越数十微米的“梯状网络”。当某一突触受到刺激时,局部的钙信号会被这些连接点捕获并放大,然后通过内质网的延伸结构逐层传递。实验观察到,这种机制能够让信号从单一突触扩展至20微米以上的树突区域,从而突破了钙信号通常局限于局部的限制。
这一现象对树突的整体功能具有深远的影响。通过这种“接力式”传递模式,单个突触的活动不仅能够调控其局部区域的生化反应,还能引发更大范围的协同作用。例如,在长时程增强(LTP)中,多个突触需要协调活动才能实现突触强度的持久增强,而ER-PM连接点正是这种协同作用的物理基础。
更重要的是,这些连接点还能够动态调节神经元的兴奋性。当钙信号通过这些连接点传播时,它们触发的分子级反应(如CaMKII的激活)可以进一步影响树突的电生理特性,使神经元对后续刺激更加敏感。这样的机制赋予了神经元高度的适应性和灵活性,使其能够快速响应环境中的复杂信号。
从微观到宏观,周期性ER-PM连接点展示了树突如何在极小的空间内高效传递信息,并最终对整个神经元的功能产生深远影响。
技术突破:如何捕捉神经元中的精细结构?
神经元复杂的微观结构,尤其是周期性内质网-质膜(ER-PM)连接点的发现,得益于一系列尖端显微技术的应用。传统光学显微镜因分辨率的限制,难以揭示亚细胞结构的细节,而在该研究中,超分辨显微镜和聚焦离子束扫描电子显微镜(FIB-SEM)的结合,为探索神经元的精细结构提供了革命性工具。
首先,研究团队利用超分辨显微镜(如3D活体格子结构照明显微镜,Lattice-SIM),对活体神经元的树突进行高分辨率成像。这项技术突破了经典光学显微镜的衍射极限,能够以接近纳米的分辨率观察ER-PM连接点的形态和分布。通过多色标记,他们成功地追踪了内质网、质膜及关键蛋白(如Ryanodine受体和CaV通道)的精准定位,为揭示“梯状”结构的功能奠定了基础。
此外,研究还借助FIB-SEM技术对固定的神经元样本进行了三维重建。这一技术通过结合离子束剖切和高分辨扫描电子成像,可以在纳米级分辨率下对样本的超微结构进行连续切片和成像。研究人员利用FIB-SEM重建了神经元的树突,并清晰地展示了周期性分布的ER-PM连接点及其与周围结构的关系。例如,他们观察到ER的横向延伸如何精准连接到质膜,形成“梯状”网络。此外,FIB-SEM还揭示了这些连接点中钙信号相关分子的三维分布模式。
这种多技术组合不仅使得周期性ER-PM连接点从“看不见”到“看得清”,还实现了从分子到细胞层面的结构功能解析。通过这些技术,研究人员能够动态捕捉ER-PM连接点如何作为钙信号枢纽,在不同时间和空间尺度上发挥作用。
神经健康的启示:从发现到治疗新策略
周期性内质网-质膜(ER-PM)连接点的发现,不仅揭示了神经元树突中钙信号传递的奥秘,还为理解和治疗神经疾病提供了全新的视角。许多神经系统疾病,如阿尔茨海默病(Alzheimer’s disease)和癫痫(epilepsy),都与钙信号调控异常密切相关。研究表明,这些疾病中常见的内质网功能障碍可能直接影响ER-PM连接点的结构和功能,进而破坏钙信号的整合与传播。
在阿尔茨海默病中,神经元内质网钙平衡的紊乱是关键病理机制之一。研究指出,某些与疾病相关的基因突变,如早老性痴呆的突变基因,可能改变ER-PM连接点的蛋白组成或间距,导致钙信号的失控。这种异常可能进一步影响CaMKII等钙依赖性分子通路的活性,削弱突触的可塑性和神经网络的功能,最终导致认知能力的下降。
对于癫痫这样的过度兴奋性疾病,ER-PM连接点的研究同样具有重要意义。这些连接点在调控神经元兴奋性方面起着关键作用。钙信号的传播过度或不足,都可能通过Ca²⁺相关通路引发异常的神经放电,导致癫痫发作。因此,针对ER-PM连接点的调控,或许能够成为一种全新的治疗策略。例如,精准干预这些连接点的钙通道功能,可能有效恢复钙信号的正常传递,从而抑制异常放电的产生。
这一发现还为神经疾病的诊断和药物开发带来了启示。通过检测ER-PM连接点的分布和功能状态,或许可以早期发现神经元功能障碍的迹象。此外,开发针对ER-PM连接点的药物,例如稳定连接点结构或调节关键蛋白活性的分子,有望成为治疗神经退行性疾病和癫痫的新选择。
周期性ER-PM连接点的发现,不仅拓展了我们对神经系统功能的认知,也为探索神经疾病的发病机制和治疗策略提供了广阔前景。这些“微观枢纽”或许正是打开神经健康新篇章的关键。
解锁神经网络的更多奥秘
周期性内质网-质膜(ER-PM)连接点的发现,为我们理解神经元内部复杂而精妙的信号调控机制提供了全新视角。这一研究不仅揭示了树突如何通过高度有序的结构实现信号的长距离传播,还为探索神经网络的整体功能奠定了基础。然而,这仅仅是揭开神经系统奥秘的冰山一角,未来还有诸多值得深入探讨的方向。
首先,关于ER-PM连接点的调控机制仍然知之甚少。这些连接点的周期性分布如何形成?它们的分子组成是否在不同类型神经元中有所差异?例如,与记忆和学习密切相关的海马神经元是否具有特殊的连接点特征?回答这些问题,不仅有助于揭示神经元结构的精确调控机制,也可能为理解脑功能的个性化差异提供线索。
其次,这些连接点在神经网络中的动态功能值得进一步研究。当前的研究主要集中于树突中的钙信号传播,未来可以扩展到其他离子或信号分子的动态调控。例如,是否有类似机制支持其他重要分子的长距离传播?此外,这种“梯状”结构是否也存在于其他神经元的亚区,例如轴突或突触末端?这些探索将有助于我们构建一个更全面的神经元功能图景。
从应用角度看,这一发现为神经疾病的治疗开辟了全新的可能性。未来可以研究ER-PM连接点在其他神经病理条件下的变化,例如中风后的神经元损伤修复或自闭症中的突触功能异常。同时,如何开发针对这些连接点的精准调控工具,例如特定的分子干预药物或基因编辑技术,也将成为一个令人期待的方向。
总之,ER-PM连接点的研究为解锁神经网络的更多奥秘点亮了一盏明灯。未来的每一步探索,都将进一步揭示大脑这一“终极机器”的复杂运行原理,为认知科学和医疗技术的发展带来更大的可能性。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


