PNAS:DNA聚合酶β缺失如何引发大脑发育隐患?科学家揭秘神经元突变背后的“沉默推手”
来源:生物谷原创 2025-08-20 13:38
本研究首次阐明了Polβ通过修复TET介导的DNA去甲基化损伤来维持神经元基因组稳定性,其缺失会导致CpG位点突变的“爆发式”积累。
近年来,自闭症、精神分裂症等神经发育障碍的发病率逐年上升,全球约1%的人口受其影响。有研究表明,这些疾病可能与大脑发育过程中的基因突变有关,比如单细胞测序技术揭示,人类皮层神经元中存在大量体细胞突变,包括单核苷酸变异(SNVs)、插入缺失(indels)和结构变异(SVs),那么这些突变是如何产生的呢?又为何集中在特定基因区域?这些问题成为研究热点。
近日,一篇发表在国际杂志Proceedings of the National Academy of Sciences上题为“DNA polymerase β suppresses somatic indels at CpG dinucleotides in developing cortical neurons”的研究报告中,来自日本大阪大学等机构的科学家们通过研究首次揭示了DNA聚合酶β(Polβ)在抑制神经元突变中的关键作用。
Polβ是碱基切除修复(BER)的核心酶,同时其还参与了TET介导的DNA主动去甲基化过程。研究发现,Polβ缺失会导致CpG二核苷酸位点的插入缺失突变激增9倍,结构变异增加5倍,且这些突变富集于神经元功能相关基因中,这一发现不仅解释了神经发育障碍的潜在分子机制,也为早期干预提供了新靶点。
神经元的精准分化依赖于基因表达的严格调控,而DNA去甲基化是激活神经元关键基因的重要步骤;然而这一过程可能引发DNA损伤。Polβ的缺失使修复系统“失灵”从而导致突变积累进而可能引发神经功能障碍。研究通过小鼠模型证实,Polβ缺陷的神经元中,CpG位点的突变显著增加,且多位于调控区和编码区,这就会直接影响突触信号传递和神经元形态发生相关基因。
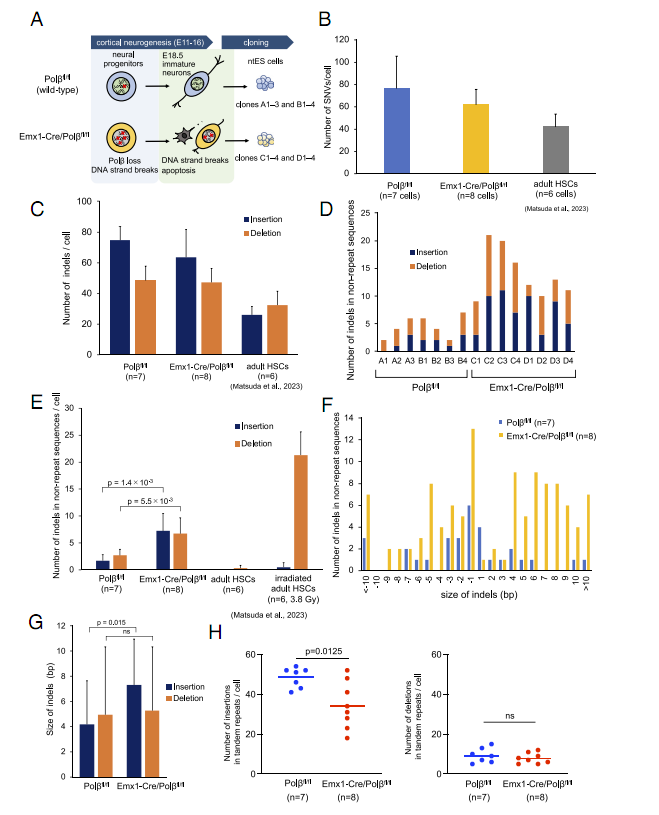
体细胞核移植对皮质神经元重编程的体细胞SNV和indel分析
这项研究中,研究人员采用Emx1-Cre/Polβfl/fl小鼠模型,特异性敲除神经前体细胞中的Polβ基因来模拟发育期神经元突变场景。他们所采用的核心技术包括:1)体细胞核移植(SCNT):将神经元核移植至去核卵母细胞,建立核移植胚胎干细胞(ntES)系,避免体外扩增引入的误差。2)全基因组测序(WGS)**:覆盖度达34%-59%,精准检测低频突变。
实验流程:
1. 样本制备:取E18.5小鼠皮层神经元,通过SCNT技术建立ntES细胞系。
2. 测序分析:使用GATK检测突变,SvABA和Manta分析结构变异,COSMIC数据库比对突变特征。
3. 功能验证:通过基因本体分析发现突变富集于神经元突触相关基因(如Ahi1、Tox3),并验证其与发育期DNA去甲基化区域的关联。
4. 关键发现:
(1)突变谱差异:Polβ缺失神经元中,非重复序列的插入缺失突变增加4倍(插入)和2.5倍(缺失),且插入片段更长(平均7.3 bp vs 4.2 bp)。
(2)CpG位点热点:66%的插入和50%的缺失发生在CpG位点±2 bp范围内,且多伴随CpG位点的增减。
(3)结构变异激增:Polβ缺失细胞中SV数量增加5倍,但移动元件插入(MEIs)无显著变化。
本研究首次阐明了Polβ通过修复TET介导的DNA去甲基化损伤来维持神经元基因组稳定性,其缺失会导致CpG位点突变的“爆发式”积累,这可能通过以下途径影响神经功能:1)调控区破坏:突变富集于增强子和启动子区,干扰转录因子(如LHX2、EMX2)结合,影响基因表达网络;2)编码区变异:如Ahi1基因的移码突变与Joubert综合征相关,提示Polβ缺陷或为神经发育疾病的诱因之一。
下一步研究人员还将进一步探索Polβ在人类神经元中的保守性以及其突变是否与临床病例的遗传易感性相关。此外,靶向Polβ的修复通路或成为预防神经发育障碍的新策略。综上,这项研究不仅揭示了大脑发育中“基因激活的代价”,也为理解精神疾病的起源提供了分子层面的线索,即当表观遗传调控与DNA修复失衡时,神经元可能为此付出突变的代价。(生物谷Bioon.com)
参考文献:
Noriyuki Sugo,Arikuni Uchimura,Risa Matsumoto, et al. DNA polymerase β suppresses somatic indels at CpG dinucleotides in developing cortical neurons, Proceedings of the National Academy of Sciences (2025). DOI:10.1073/pnas.2506846122
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


