Nature Communications:趋化因子受体CCR5的配体识别及信号转导机制研究获进展
来源:上海药物所 2021-07-07 12:05
免疫细胞的定向迁移是人体发生和完成免疫应答的必要条件。趋化因子及其受体系统控制细胞的定向迁移,在病原体的感染与清除、炎症反应、细胞及器官的发育、创伤的修复、肿瘤的形成及转移、移植免疫排斥等方面发挥重要作用,是目前治疗各类炎症、艾滋病和癌症等疾病的热门靶点。针对趋化因子受体开展结构和功能研究可为相关药物的开发提供基础和依据。趋化因子受体
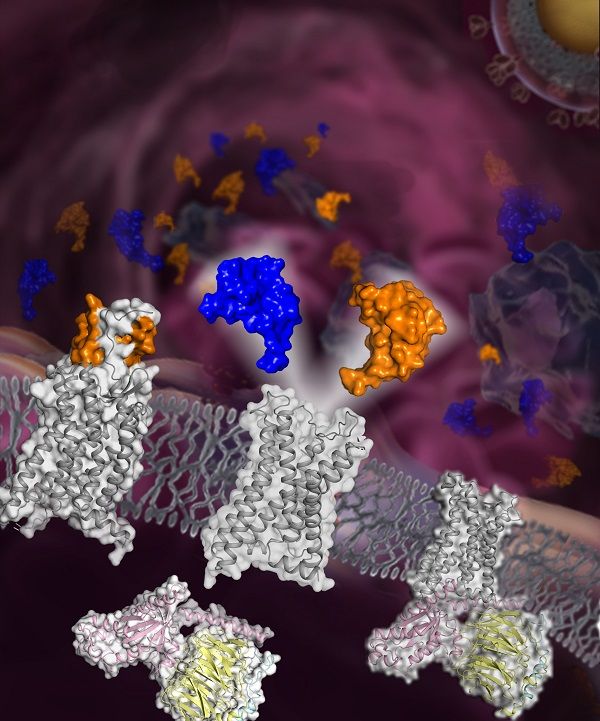
免疫细胞的定向迁移是人体发生和完成免疫应答的必要条件。趋化因子及其受体系统控制细胞的定向迁移,在病原体的感染与清除、炎症反应、细胞及器官的发育、创伤的修复、肿瘤的形成及转移、移植免疫排斥等方面发挥重要作用,是目前治疗各类炎症、艾滋病和癌症等疾病的热门靶点。针对趋化因子受体开展结构和功能研究可为相关药物的开发提供基础和依据。
趋化因子受体CCR5和多种免疫相关炎症性疾病(如多发性硬化症、风湿性关节炎、动脉粥样硬化、移植排斥和自身免疫性疾病等)、癌症及病原体感染密切相关,但CCR5的细胞信号识别与转导机制尚未被明确阐明。
近日,中国科学院上海药物研究所研究员吴蓓丽课题组、研究员赵强课题组和研究员许叶春课题组联合运用单颗粒冷冻电镜技术、X射线晶体衍射法以及动态构象计算模拟等方法,结合功能实验对CCR5的配体识别及信号转导机制进行了系统研究:成功解析了CCR5分别与两种内源性配体(MIP-1α与RANTES)及G蛋白的复合物电镜结构,以及CCR5在不结合配体状态下与G蛋白的复合物电镜结构,同时还解析了CCR5与MIP-1α的高分辨率晶体结构。该研究全面系统地阐释了CCR5对内源性配体的识别机制和对细胞信号的转导机制,以及组成性激活状态下的受体激活机制。7月6日,相关研究成果以Structural basis for chemokine recognition and receptor activation of chemokine receptor CCR5为题,发表在Nature Communications上。这是吴蓓丽课题组继2013年在Science上发表的有关CCR5与抗艾滋病药物maraviroc的复合物结构后在趋化因子受体方面的又一研究成果。
已有研究表明,趋化因子受体的N端区域对内源性趋化因子的识别具有重要意义,但已报道的趋化因子受体结构中均不包含完整的受体N端。该研究中,研究人员通过解析CCR5与MIP-1α的复合物高分辨率晶体结构,并结合二硫键交联、分子动力学模拟,阐明了CCR5的N端与趋化因子的精细作用模式,为深入理解趋化因子的特异性识别机制提供了重要信息。
通过比较CCR5分别与两种不同趋化因子结合的复合物结构,研究人员发现,与结合MIP-1α的受体相比,CCR5与RANTES结合后其第一和第二个跨膜螺旋向外偏移,配体结合口袋开口增大,从而容纳体积较大的RANTES的N端。这一发现提示,CCR5跨膜螺旋构象的可塑性为其结合不同的趋化因子提供结构基础。
与此前解析的CCR5处于非激活态的结构相比,MIP-1α和RANTES的N端插入到受体的跨膜螺旋口袋中,通过与受体氨基酸Y251形成氢键作用,将受体中的关键氨基酸W248的构象稳定在激活状态。此外,研究人员还发现,CCR5不结合配体时,受体第二个跨膜螺旋上氨基酸W86的侧链翻转90度,并进一步通过与Y108、Y251、W248等形成疏水相互作用将受体稳定在激活构象,从而促使受体与G蛋白结合。该研究首次阐明了趋化因子受体的组成性激活机制。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


