Sci Adv:南方科技大学宋学军团队报道麻醉大脑意识主动重启机制——激活兴奋解除抑制,双管齐下
来源:brainnews 2025-12-11 14:11
这项研究不仅揭示了EphB1-NR2B通路在麻醉苏醒中的关键作用,还与之前发现的KCC2氯离子通道共同构建了完整的"麻醉苏醒双通道理论"。
深刻认识大脑意识消失后重新启动的分子神经机制对意识障碍和意识障碍性疾病的防治至关重要,对超级人工智能的发展进步具有重要价值。
南方科技大学宋学军团队近年来的研究揭示了麻醉大脑意识消失后主动重启的分子神经机制,麻醉药物代谢清除是意识复苏的前提条件,但不是充分条件,这就可以解释了临床麻醉后部分病人复苏延迟和认知功能长期不能完全恢复的现象;并进一步揭示了大脑重新获得意识是一个由大脑内在驱动力主导的主动过程(主动复苏),而不是随着麻醉药物代谢就能够理所当然、自然而然地恢复的(被动复苏)。
丘脑腹后内侧核(ventral posterior nucleus of thalamus,VPM)中钾-氯共转运体2(potassium-chloride co-transporter 2,KCC2)的泛素降解是驱动麻醉大脑意识复苏的核心内在驱动力(见宋学军团队的近期研究综述报道(Nature Neurosci, 2023, PNAS, 2024, Trends Neurosci 2024)。
该研究提出并初步论证了麻醉意识“主动复苏理论”。
2025年12月5日,南方科技大学宋学军团队在Science子刊《Science Advances》上,以EphB1-NR2B receptor signaling in glutamatergic neurons of the ventroposteromedial thalamic nucleus regulates emergence from anesthesia 为题发表的最新研究,进一步拓展了意识主动复苏的分子神经机制,并鉴定了意识主动重启的丘脑-皮层神经环路,进一步完善意识主动恢复理论。
在这项最新研究中,该团队继续延用其同时使用多个不同靶点全身麻醉剂(丙泊酚、氯胺酮和异氟烷)并鉴定其共同点的思维方法。实验动物(小鼠)的意识状态采用七个不同鉴定指标以期望比较综合评估意识水平,并聚焦最低意识反应状态(minimum response state,MRS,相当于临床的深度麻醉,满足大部分手术需求的麻醉深度,浅麻醉的意识消失状态通常是不能满足大部分手术要求的)。
EphB受体是一类受体酪氨酸激酶家族,可通过磷酸化下游离子通道,调节突触传递和神经元兴奋性。
研究发现,在小鼠MRS状态下,VPM中的EphB1受体显著激活。敲低VPM中EphB1受体可以延迟麻醉大脑VPM神经元活性恢复和意识复苏进程;药理学激活或抑制EphB1受体,分别加速或延迟小鼠麻醉意识复苏。证明VPM中EphB1受体激活促进VPM神经元活性恢复和小鼠麻醉意识复苏(图1)。
作者进一步探究了EphB1受体激活VPM神经元介导小鼠麻醉意识复苏的环路机制,用化学遗传技术操纵神经元活性,发现激活VPM神经元中的EphB1受体可以加速意识复苏,而抑制VPM神经元则抑制意识复苏。显示了VPM中EphB1受体活性在麻醉意识复苏中的重要作用(图2)。
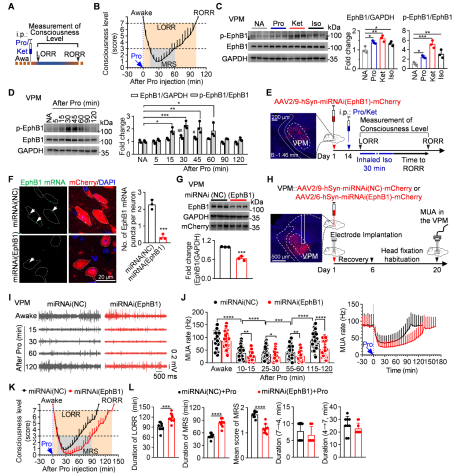
图1
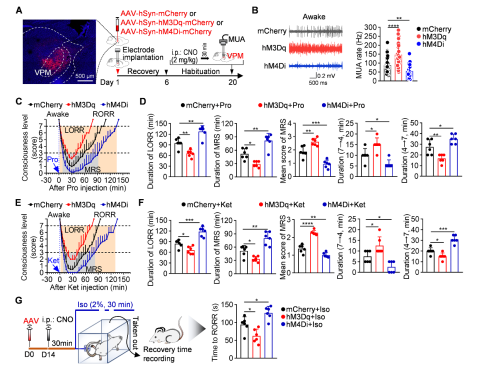
图2
既往研究发现,丘脑VPM核团与初级体感皮层(primary somatosensory cortex, S1)之间存在明确的神经投射。
研究者通过化学遗传学技术,结合在体电生理记录和双光子钙成像技术发现,激活VPM神经元可显著减轻丙泊酚对S1神经元活性的抑制,并加速小鼠意识恢复,反之亦然。为进一步探究VPM→S1通路在麻醉意识复苏中的作用,研究人员特异性操控投射至S1的VPM神经元,发现激活这群神经元可显著加速麻醉恢复;抑制这群神经元则延迟麻醉恢复。
值得注意的是,操控其他投射至S1的丘脑核团均未对麻醉苏醒产生影响,凸显了VPM→S1通路在麻醉觉醒中的特异性作用(图3)。
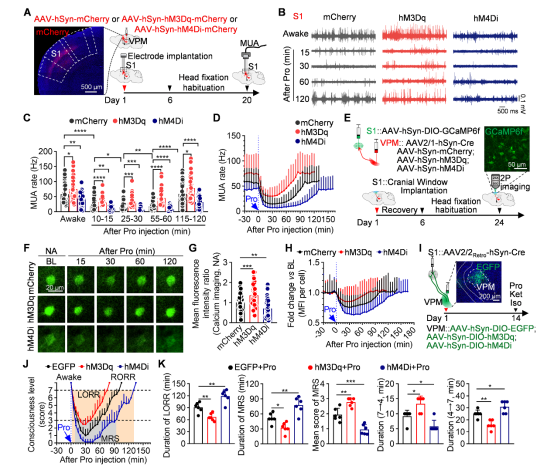
图3
研究者证实丘脑VPM神经元全部为谷氨酸能神经元(VPMGlu),而接收其投射的S1皮层神经元中,84%为谷氨酸能(S1Glu),16%为GABA能(S1GABA)。通过双病毒系统特异性调控VPMGlu投射的S1Glu或S1GABA神经元,发现VPMGlu→S1Glu特异性兴奋性投射是调控全麻苏醒的关键神经环路,而非VPMGlu→S1GABA通路(图4)。
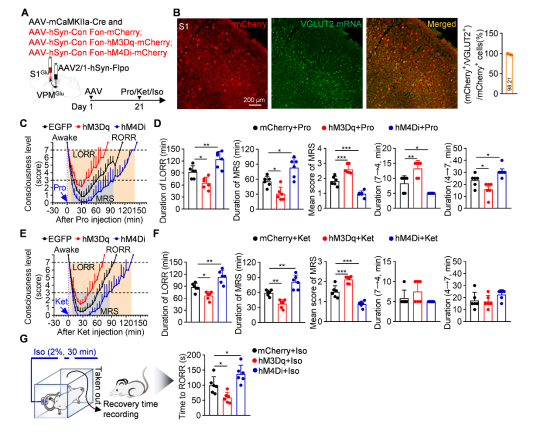
图4
研究者特异性敲低投射至S1Glu神经元的VPMGlu神经元中EphB1受体后,发现其可以显著增强丙泊酚对VPM-S1环路的电活动抑制,并显著延迟麻醉意识复苏,证明EphB1通过兴奋VPM→S1谷氨酸能通路促进麻醉意识复苏(图5)。
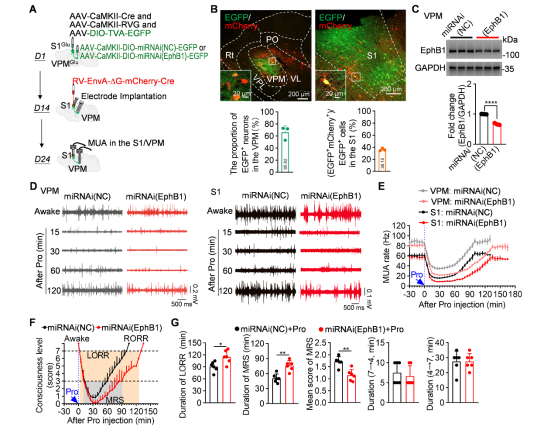
图5
在确定环路后,研究者进一步寻找EphB1影响麻醉恢复的分子机制。发现在MRS状态下VPM中的NMDA受体的NR2B亚基(Y1472位点)磷酸化水平显著升高。特异性敲低EphB1则可完全逆转NR2B-Y1472位点的磷酸化,同时抑制麻醉药诱导的NMDA受体介导的钙离子内流增强。这表明VPM中EphB1-NR2B通路激活是麻醉后意识复苏的重要环节(图6)。
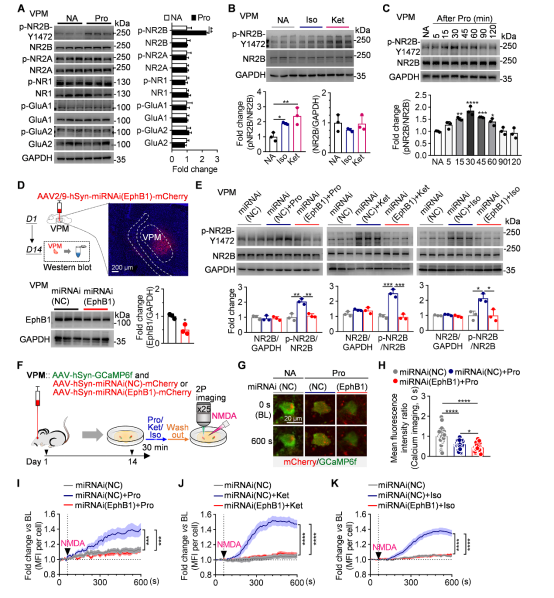
图6
研究通过特异性过表达NR2B(Y1472F)突变体,抑制了VPM神经元NR2B酪氨酸磷酸化。过表达突变NR2B后,不仅减少了NMDA受体在VPM神经元细胞膜上的表达,还完全逆转了麻醉药诱导的NMDAR介导的钙内流增强,增强丙泊酚对VPM-S1神经环路的电活动抑制,延迟麻醉意识复苏。这充分证明,NR2B Y1472位点的磷酸化是驱动麻醉苏醒的关键分子事件(图7-8)。
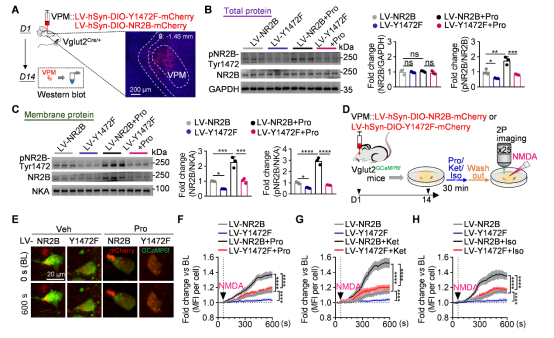
图7
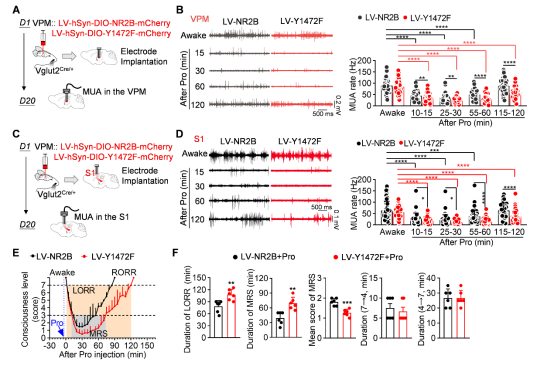
图8
此外,EphB1作为受体酪氨酸激酶,在麻醉状态下,EphB1的激活不仅可以通过磷酸化NMDA受体调控神经元兴奋性,还参与调控氯离子共转运蛋白KCC2的泛素化降解。特异性敲低EphB1可有效阻止丙泊酚引起的KCC2泛素化增加及KCC2降解,并逆转丙泊酚对KCC2氯离子转运功能的抑制,从而维持GABAAR激活介导的正常氯离子内流。这表明VPM中EphB1-KCC2通路是麻醉后意识复苏的重要环节(图9)。
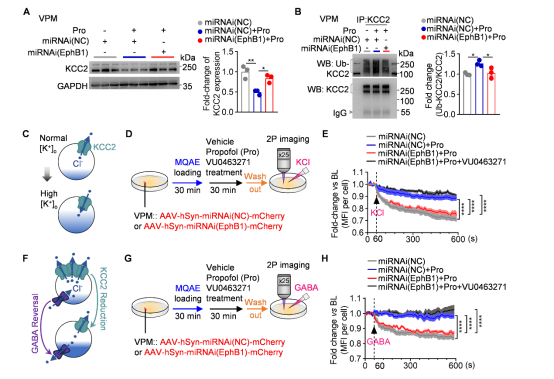
图9
进一步实验证实,EphB1-NMDAR通路与EphB1-KCC2通路相互独立,共同促进VPM神经元活性恢复和麻醉意识复苏(图10)。
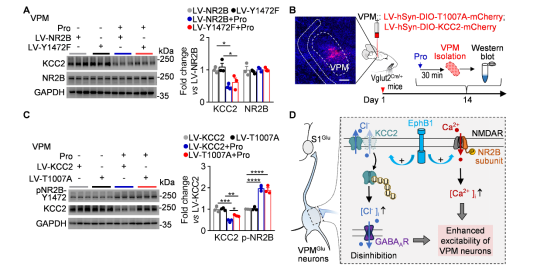
图10
这项研究不仅揭示了EphB1-NR2B通路在麻醉苏醒中的关键作用,还与之前发现的KCC2氯离子通道共同构建了完整的"麻醉苏醒双通道理论"。
激活的EphrinB-EphB1受体信号同时作用于两个独立通路:一方面通过磷酸化NMDA受体的NR2B亚基,增强钙离子内流,直接兴奋神经元,如同踩下"油门";另一方面促进KCC2的泛素化降解,削弱抑制性信号,相当于解除"刹车"。
这种双管齐下的策略,使VPM神经元能快速从麻醉抑制中恢复活性,从而促进意识恢复。该发现完善了麻醉意识主动复苏理论,为促进麻醉苏醒、治疗意识障碍提供了新靶点。
该研究第一作者是博士研究生刘岳鑫(现复旦大学附属中山医院麻醉科医师)、胡江建和曹伯旭,通讯作者是宋学军教授。该研究得到国家自然科学基金和深圳市医学研究基金项目支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


