奥胡斯大学新发现颠覆以往认知:抗原只需结合一个受体就能激活B细胞!
来源:生物探索 2023-05-08 11:26
这项发现的意义并不局限于免疫学领域,对于一般细胞生物学而言,这项研究也为人们了解细胞表面受体如何将信号发送到细胞内提供了新的思路。
在成长为真正能够抵御细菌或病毒感染的记忆B细胞和效应B细胞(浆细胞)之前,那些从未接受过抗原刺激的初始B细胞(naive B cell)需要经历激活的步骤。这一步依赖于B细胞表面的BCR-Igα/Igβ复合物将细胞外“抗原来了”的信号传递到细胞内,使初始B细胞“知道”自己该进行增殖和分化了。
BCR-Igα/Igβ复合物由两部分构成。BCR即B细胞受体(B-cell receptor),就像一把钥匙能够打开对应的门,BCR也能够识别特定的抗原,而这个特定抗原上真正与BCR结合的微小区域,被称之为表位(Epitope),相当于门上的锁孔。然而,在构成BCR的重链蛋白和轻链蛋白中,仅有重链蛋白是跨越细胞膜进入细胞内部的,但进入细胞内部的这部分长度也仅有几个氨基酸,无法承担传递重要信号的责任。
为此,B细胞为BCR配备了两种辅助蛋白,即Igα和Igβ,它们与重链蛋白结合,并伸入到细胞内部。虽然它们并不具备识别抗原的功能,但是却能够辅助BCR完成信号的传导。
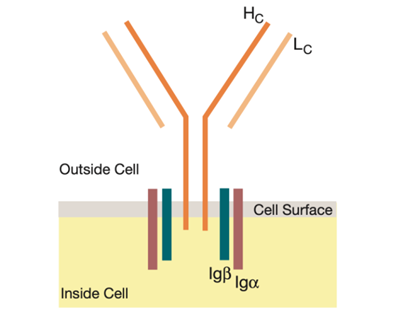
图1 BCR-Igα/Igβ复合物(图源:[1])
受体激活的经典观点认为,为了产生足够强的激活信号,B细胞表面上的许多BCR必须聚集到一起。BCR可以通过与单个抗原上多次出现的表位相结合而形成BCR簇,比如某个蛋白质的某段氨基酸序列重复多次,就形成了多个表位;也可能是BCR与入侵者表面的多个聚集在一起的抗原结合形成BCR簇;还可能是BCR与簇集到一起的抗原表位(如一簇蛋白质)结合形成BCR簇。不管是哪种情况,BCR簇的形成被认为是必须的。免疫学家把这种BCR-Igα/Igβ复合物与抗原结合而发生聚集的现象称为“crosslinked”。
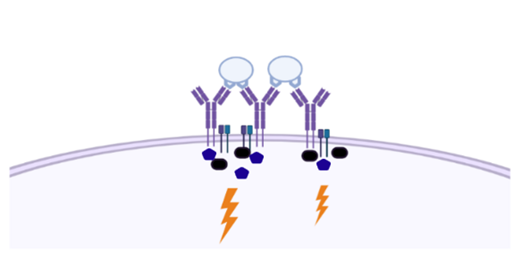
图2 受体激活的经典模型。抗原(浅蓝色)与多个BCR(紫色)结合,信号分子(深蓝色和黑色)因此能够聚集,并将信号(闪电符号)发送到细胞内。(图源:[2])
然而,奥胡斯大学最近发表的一项研究挑战了这一观点。这项发表在Nature Communications上的文章“Antigen footprint governs activation of the B cell receptor” 提出了一个由抗原足迹(antigen footprint)控制的 BCR 激活模型。根据这个模型,即使那些一次只能结合一个受体的抗原也能够激活B细胞,但这要求该抗原的足迹满足一定的条件,即具备一定的抗原大小和刚度。

图3 研究成果(图源:[3])
研究人员使用一种名为DNA PAINT的突破性超分辨率显微镜技术对静息状态的初始B细胞进行了成像。该方法使得核酸纳米结构的单分子可视化成为可能,分辨率可达到5-10nm。结果发现,当初始B细胞处于静息状态时,BCR并非像以往认为的那样以有组织的方式聚集,而是多以单体、二聚体或松散联结的簇的形式排布在细胞膜上,其最近邻的Fab间距约为20-30 nm。
为了进一步确定抗原激活BCR的最低要求,研究人员使用了一种名为Holliday交叉的纳米支架来精确控制抗原的属性。该支架类似于DNA同源重组时会出现的一种核酸结构。
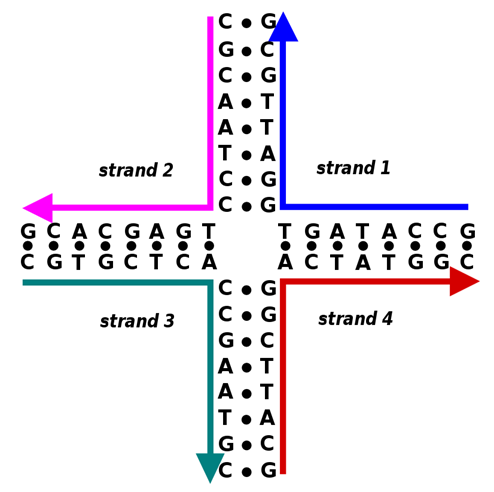
图4 Holliday交叉(图源:维基百科)
结果发现,单价抗原和多价抗原诱导的激活之间没有质的区别。这里的“单价”、“多价”,即指抗原上拥有一个或多个表位。不过,单价抗原仅在高浓度时可以激活BCR,但如果抗原分子的尺寸或刚度太小,即抗原足迹不达标,也不能激活BCR。
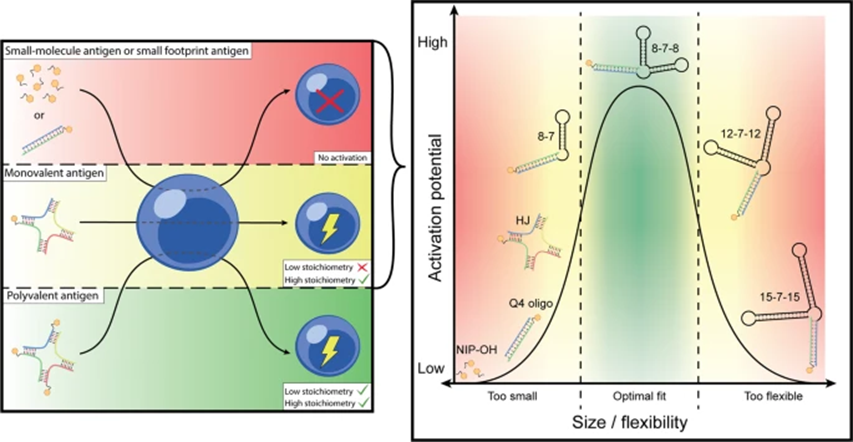
图5 尺寸和刚度的组合决定了激活的程度(图源:[3])
研究的资深作者、奥胡斯大学生物医学系副教授Søren Degn说:“之前教科书上说,来自病毒或疫苗等的抗原必须与细胞表面的 B 细胞受体发生交联,但现在我们证明,即是抗原一次只能结合一个受体,也能激活B细胞。”
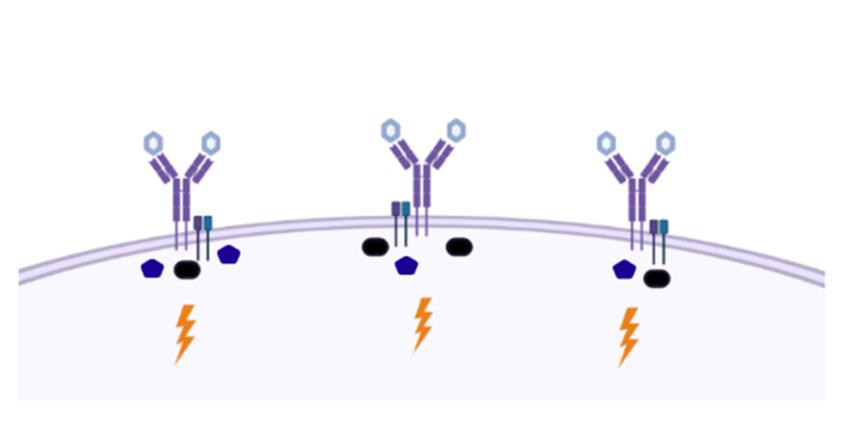
图6受体激活新模型(图源:[2])
Søren教授表示,这一发现在几个层面上都具有重要意义:它代表我们更新了对免疫细胞如何“识别”抗原的理解,这将有助于在设计新疫苗时模仿这种机制,使疫苗能够发挥最大作用。另一方面,人们也可能利用这种机制,在过敏和自身免疫性疾病等有害的情况下关闭B细胞的激活。关于这两方面的研究,正在奥胡斯大学的CellPAT基础研究中心进行,Søren教授说。
此外,这项发现的意义并不局限于免疫学领域,对于一般细胞生物学而言,这项研究也为人们了解细胞表面受体如何将信号发送到细胞内提供了新的思路。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


