Science子刊:高金明团队开发纳米STING激动剂,诱导强大的抗肿瘤免疫
来源:生物世界 2024-03-01 11:20
这项研究结果表明,“冲击-锁定”(shock-and-lock)的STING激动剂直接靶向cDC1提供了一种有前途的方法用于STING介导的癌症免疫治疗。
德克萨斯大学西南医学中心高金明教授团队在 Science Immunology 期刊发表了题为:STING licensing of type I dendritic cells potentiates antitumor immunity 的研究论文。
该研究通过将cGAMP封装在聚合物PSC7A组成的胶束基质中,构建了pH敏感性纳米颗粒STING激动剂——PolySTING,这种独特新颖的设计为STING活化提供了“冲击-锁定”(shock-and-lock)机制,将cGAMP的冲击性STING激活与PSC7A的非典型、持续性活性协同起来。
PolySTING能够特异靶向常规1型树突状细胞(cDC1),并依赖cDC1中STING-I-IFN激活,产生强大的抗肿瘤免疫疗,同时显示出比传统STING激动剂更宽的治疗窗口,具有良好的临床转化应用前景。

STING在包括癌细胞在内的多种细胞群中广泛表达,具有不同的细胞功能,如I型干扰素的激活、诱导自噬或诱导凋亡。目前尚不清楚哪些免疫细胞、基质细胞或癌细胞亚群对STING介导的抗肿瘤免疫尤为重要。
在这项研究中,研究团队利用聚合物STING激动剂(PolySTING)来研究免疫细胞亚群在STING介导的抗肿瘤免疫中的作用。之前使用小分子STING激动剂的研究表明,它们很容易被T细胞摄取,导致STING介导的T细胞死亡和T细胞记忆丧失。高金明团队之前的工作还表明,仅通过cGAMP激活STING会在6小时内迅速激活(shock),随后在12小时后发生溶酶体降解和功能丧失,而合成聚合物通过聚合物介导的STING生物分子凝聚诱导了48小时内较慢但更持久的I型IFN表达(lock)。
该研究的PolySTING设计中,cGAMP被封装在聚合物PSC7A组成的胶束基质中,形成一种“冲击-锁定”(shock-and-lock)的STING纳米颗粒激动剂。这种设计将cGAMP的冲击性STING激活与PSC7A的非典型、持续性活性协同起来。PolySTING对髓系细胞的趋向性最小,在T细胞中的摄取最小,以避免STING介导的T细胞死亡。PolySTING的细胞趋向性和“冲击-锁定”STING激活允许我们识别常规1型树突状细胞(cDC1)作为恶性肿瘤排斥的关键细胞驱动器。

该研究还进一步发现了cDC1中STING激活的免疫标志物组合——XCR1+STING+CXCL9+,该标志物组合的高表达与患者的良好预后密切相关,这表明了STING活化的cDC1可能作为患者对癌症免疫疗法反应的预后生物标志物。
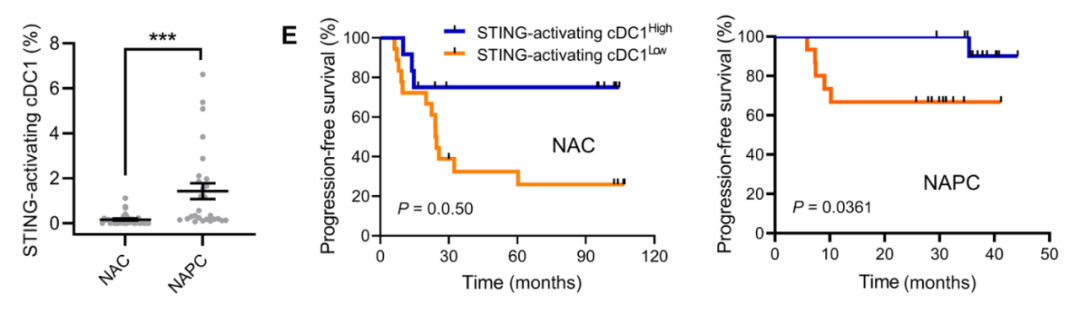
STING活化的cDC1与癌症患者的生存率相关
这项研究结果表明,“冲击-锁定”(shock-and-lock)的STING激动剂直接靶向cDC1提供了一种有前途的方法用于STING介导的癌症免疫治疗。
王建(天津医科大学肿瘤医院教授)、李苏昕(中国药科大学教授)和Maggie Wang为该论文共同第一作者,德克萨斯大学西南医学中心高金明教授为论文通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


