Nature communications: CHMP2A调节自然杀伤细胞对肿瘤细胞杀伤
来源:生物谷原创 2022-04-18 20:12
自然杀伤(NK)细胞在肿瘤免疫监测中发挥着关键作用,因为它们能够识别和杀死血液系统恶性肿瘤和实体瘤,包括控制转移疾病。基因组研究表明,癌症中存在多种不同的基因变化,其中一些突变可以诱导免疫细胞产生耐药
自然杀伤(NK)细胞在肿瘤免疫监测中发挥着关键作用,因为它们能够识别和杀死血液系统恶性肿瘤和实体瘤,包括控制转移疾病。基因组研究表明,癌症中存在多种不同的基因变化,其中一些突变可以诱导免疫细胞产生耐药性或增加其敏感性。
虽然已经发现了许多NK细胞的激活和抑制配体,但这些并不能完全解释肿瘤细胞对NK细胞介导的活性敏感或抵抗的机制。最近,“双细胞类型”(TCT)CRISPR-Cas9筛选已被用于模拟肿瘤的突变多样性,以确定调节NK细胞或T细胞介导的抗肿瘤活性的新机制。

图片来源: https://doi.org/10.1038/s41467-022-29469-0
近日,加州大学圣地亚哥分校的研究者们在nature communications杂志上发表了题为“CHMP2A regulates tumor sensitivity to natural killer cell-mediated cytotoxicity”的文章,该研究阐明了肿瘤免疫通过EVS分泌逃逸的机制,并确定抑制CHMP2A和相关靶点是改善NK细胞介导的免疫治疗的机会。
已知自然杀伤(NK)细胞可以介导多种癌症类型的杀伤,但肿瘤细胞可以发展抵抗机制来逃避NK细胞介导的杀伤。在这里,研究者使用“双细胞型”全基因组CRISPR-Cas9筛选系统来发现人类胶质母细胞瘤干细胞(GSC)对肿瘤敏感性和对NK细胞介导的细胞毒的抵抗力的关键调节因子。
研究者确认CHMP2A是GSC抵抗NK细胞介导的细胞毒作用的调节因子,研究者在头颈部鳞状细胞癌(HNSCC)模型中证实了这些发现。研究者发现CHMP2A的缺失激活了肿瘤细胞中的NF-κB,从而介导了趋化因子分泌的增加,促进了NK细胞向肿瘤细胞的迁移。
在HNSCC模型中,研究者证明CHMP2A通过分泌表达MICA/B和TRAIL的细胞外小泡(EV)来介导肿瘤对NK细胞的抵抗。这些分泌的配体可诱导NK细胞的凋亡,从而抑制其抗肿瘤活性。为了证实这些体外研究,研究者证明了在异种移植免疫缺陷小鼠模型中,CAL27 HNSCC细胞中CHMP2A的缺失导致NK细胞介导的杀伤增加。
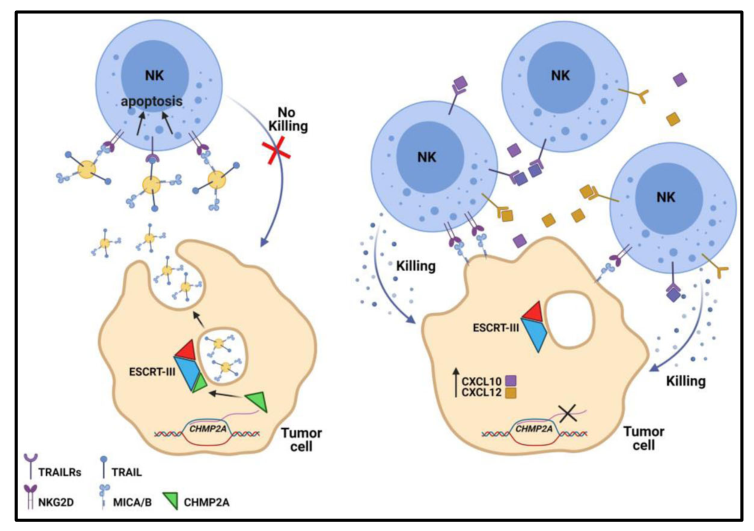
CHMP2AKO在肿瘤细胞中的机制图
图片来源: https://doi.org/10.1038/s41467-022-29469-0
总之,研究者使用TCT CRISPR筛查发现了调节肿瘤对NK细胞敏感性的关键基因。这项研究解释了GBM和HNSCC对NK细胞介导的杀伤产生抵抗的机制。这些数据表明CHMP2A和肿瘤分泌的EVS可以诱导NK细胞的凋亡,从而限制了它们的细胞毒潜力。评价CHMP2A在患者体内的表达和肿瘤分泌EV的特征可能解释免疫逃逸的一些机制,并加速针对这些免疫抑制过程的新药的开发。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


