Nature子刊:一个超增强子调控的RNA结合蛋白级联反应驱动胰腺癌
来源:生物谷原创 2023-09-12 13:29
胰腺癌的5年生存率为11%,预计将成为本十年美国癌症相关死亡的第二大原因,胰腺导管腺癌(PDAC)占所有胰腺癌病例的90%以上。
胰腺癌的5年生存率为11%,预计将成为本十年美国癌症相关死亡的第二大原因,胰腺导管腺癌(PDAC)占所有胰腺癌病例的90%以上。虽然PDAC的常见突变情况和驱动因素已经确定,但这一知识尚未转化为持久的治疗方法,因为Kras和Myc等靶点已被证明是难以解决的。因此,识别维持肿瘤生长所需的分子通路中的脆弱性是一个活跃的研究领域。

图片来源:https://doi.org/10.1038/s41467-023-40798-6
近日,来自加州大学圣地亚哥分校的研究者们在Nature Communications杂志上发表了题为“A super-enhancer-regulated RNA-binding protein cascade drives pancreatic cancer”的文章,该研究揭示了一个超增强子调控的RNA结合蛋白级联反应驱动胰腺癌。
胰腺导管腺癌(PDAC)是一种致命的恶性肿瘤,需要新的治疗方案。使用对超级增强子(SE)作为参与细胞特定功能的核心基因的哨兵的无偏分析,研究者在本研究中发现了一个可药物的SE介导的RNA结合蛋白(RBP)级联,它通过增强mRNA翻译来支持PDAC生长。
这一级联反应是由RBP异质核糖核蛋白F相关的SE驱动的,它稳定蛋白质精氨酸甲基转移酶1(PRMT1),进而控制翻译介体泛素相关蛋白2类。所有这三个基因和调控的SE对PDAC的生长是必不可少的,并受Myc癌基因的协调调控。
与此一致,通过抑制PRMT1对RBP网络的调制揭示了Myc-High PDAC患者有机体的独特脆弱性,并显著减少了雄性小鼠的肿瘤生长。本研究强调了表观遗传调控和mRNA翻译之间的功能联系,并确定了组成PDAC意想不到的治疗靶点的成分。
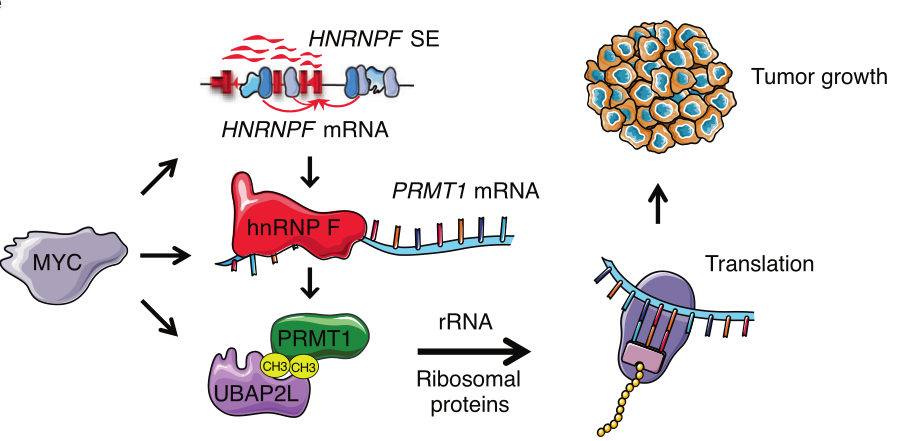
机制总结图
图片来源:https://doi.org/10.1038/s41467-023-40798-6
总而言之,本研究结果提供了一种可用药的分子机制,肿瘤细胞可以通过这种机制放大翻译以维持肿瘤的形成。这是在SE水平上完成的,允许细胞通过Hnrnpf-Prmt1-Ubap2l轴安装协调响应。Myc对这三个关键的相互依赖的蛋白质合成调节因子的协同控制为靶向胰腺癌和潜在的其他癌症提供了一种替代方法。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


