Cell Death and Disease:类器官模型揭示 ULBP2 CAR-T 细胞对胃癌的杀伤作用
来源:肠道类器官 2025-08-12 16:30
该研究明确 UL16 结合蛋白 2(ULBP2)为胃癌潜在治疗靶点,揭示其通过激活转化生长因子 -β(TGF-β)信号通路促进癌相关成纤维细胞(CAFs)活化及肿瘤进展的机制。


该研究聚焦胃癌治疗难题,针对其致密基质微环境导致的治疗 resistance 问题,发现 ULBP2 通过激活 TGF-β 信号通路促进癌相关成纤维细胞活化,加剧肿瘤进展。研究者开发的 ULBP2 CAR-T 细胞,在体外可有效清除胃癌细胞系及患者来源类器官,体内在细胞系衍生异种移植和患者来源异种移植模型中,单独或联合抗 PD-1 抗体均显著抑制肿瘤生长、延长生存期,还能减少基质沉积、促进 T 细胞浸润。这项工作为胃癌免疫治疗提供了新靶点与联合策略,对实体瘤 CAR-T 疗法发展具有重要参考价值。
技术路线图
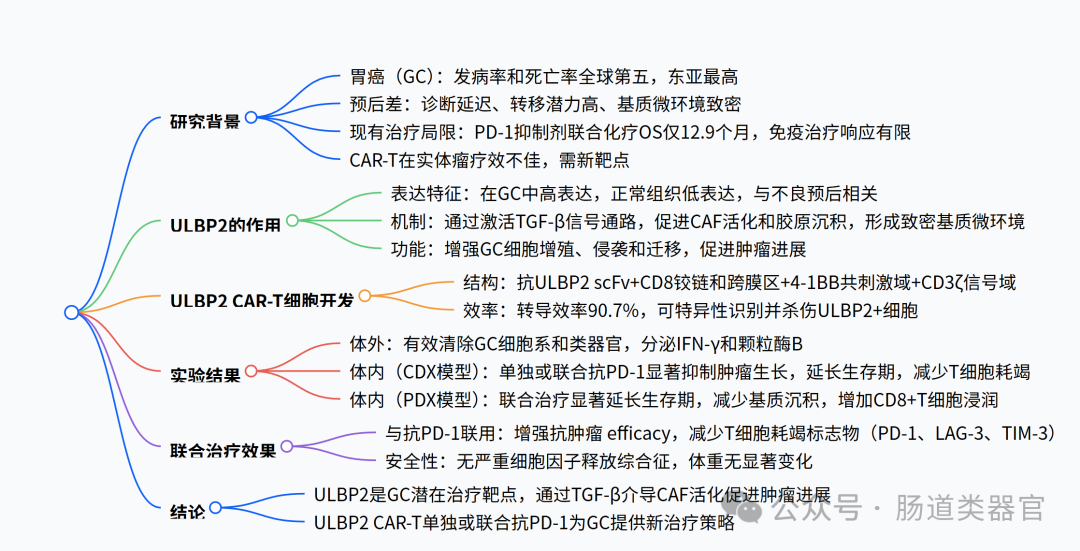
科学背景与研究现状
胃癌(Gastric Cancer, GC)作为全球范围内严重威胁人类健康的重大疾病,在肿瘤领域占据着极为重要的地位。从全球疾病负担角度来看,其发病率位居所有恶性肿瘤的第五位 ,每年新增病例超百万;而死亡率更是高居第三位,成为导致癌症相关死亡的主要原因之一 。在地域分布上,胃癌呈现出显著的不均衡性,东亚地区堪称胃癌的高发地带,以中国为例,全球近 44% 的胃癌新发病例集中于此 。如此高的发病率与死亡率,使得胃癌的防治成为医学领域亟待攻克的难题。
深入剖析胃癌的发病机制,是探寻有效防治策略的关键所在。已知幽门螺杆菌(Helicobacter pylori)慢性感染是引发胃癌的主要危险因素,尤其是对于非贲门部胃癌,约 90% 的患者幽门螺杆菌血清学检测呈阳性 。此外,不良的生活习惯,诸如过度饮酒、吸烟,以及长期摄入高盐、含大量防腐剂的食物等,均在胃癌的发生发展进程中扮演着推波助澜的角色 。在分子机制层面,肿瘤的形成与演进涉及多个复杂环节,其中肿瘤突变负荷增加、免疫逃逸现象以及表观遗传修饰改变等,都与胃癌的发生发展密切相关 。比如,DNA、RNA 以及蛋白质层面的甲基化修饰,作为常见的表观遗传修饰方式,在胃癌的发生发展中发挥着重要作用 。然而,尽管目前对胃癌发病机制有了一定程度的认识,但距离全面清晰地阐明仍有很长的路要走,诸多细节与潜在机制仍有待深入挖掘。
胃癌的临床诊疗现状同样面临着诸多严峻挑战。由于胃癌早期症状隐匿,缺乏特异性表现,多数患者确诊时病情已进展至中晚期。以我国为例,高达 70% 的患者在确诊时已处于进展期 。这一现状极大地限制了治疗手段的选择与疗效。在传统治疗方案方面,以铂类药物为代表的一线治疗方案,对于晚期胃癌的疗效极为有限,且往往伴随着显著的副作用,极大地降低了患者的生活质量 。即便近年来免疫治疗如程序性死亡受体 1(Programmed Death Receptor 1, PD-1)抑制剂联合化疗等方案的出现,在一定程度上改善了部分患者的预后,但整体效果仍不尽人意。例如,PD-1 抑制剂联合化疗的方案,患者的总生存期(Overall Survival, OS)仅为 12.9 个月 ,且免疫治疗的响应率有限,并非所有患者都能从中获益 。在围手术期治疗领域,虽然新辅助化疗联合免疫治疗在部分 Ⅱ 期研究中展现出一定的缩瘤降期效果,但在 Ⅲ 期临床研究中,如 KEYNOTE-585 研究,未能在全人群中将围手术期病理缓解转化为长期生存获益 。这一系列问题充分表明,当前胃癌的治疗手段远未达到理想状态,亟待创新治疗靶点与策略的出现。
在这样的背景下,针对胃癌的深入研究显得尤为必要且意义重大。一方面,深入探究胃癌发生发展的分子机制,有望挖掘出全新的治疗靶点,为开发更具针对性、更有效的治疗手段奠定基础 。另一方面,优化现有治疗方案,精准筛选出能够从不同治疗手段中获益的人群,提高治疗的有效性与安全性,也是当务之急 。此外,开发新的诊断技术,实现胃癌的早期精准诊断,对于改善患者预后、降低死亡率具有不可估量的价值 。本研究聚焦于胃癌治疗难题,围绕致密基质微环境导致的治疗抵抗问题展开,致力于发现新的治疗靶点,开发创新治疗策略,以期为胃癌的临床治疗带来新的曙光,这对于填补当前胃癌研究空白、突破治疗瓶颈、提升患者生存质量与延长生存期,无疑具有深远的科学意义与临床应用价值。
实验技术方法
1. 胃癌类器官(Gastric Cancer Organoids)的分离与培养
样本来源
关键试剂
详细步骤
肿瘤组织用含 2 mM 谷氨酰胺和 10% FBS 的 DMEM/F12 洗涤后,用剪刀剪碎为小块;
加入 0.1 mg/mL 胶原酶 IV,37°C 恒温消化 30 分钟,期间轻柔震荡;
加入等量洗涤培养基终止消化,通过 100 μm 细胞筛过滤,收集筛上的细胞团;
300 g 离心 5 分钟,弃上清,细胞团重悬于 50% Matrigel 与 50% 类器官培养基的混合液中;
以 50 μL 液滴形式接种到预热的 24 孔板中央,37°C、5% CO₂培养箱中静置 30 分钟使 Matrigel 固化;
每孔加入 0.5 mL 类器官培养基,每 3-4 天更换一次培养基,观察类器官生长状态。
2. 类器官与癌相关成纤维细胞(CAFs)的共培养
目的
模拟肿瘤微环境中类器官与 CAFs 的相互作用,研究 ULBP2 对 CAF 活化的影响。
关键试剂
预冷磷酸盐缓冲液(PBS)、胰酶、共培养培养基、Matrigel。
详细步骤
类器官从 Matrigel 中解离,用预冷 PBS 反复洗涤以去除残留基质,计数后重悬于共培养培养基;
贴壁培养的 CAFs 用胰酶消化,离心后重悬于共培养培养基并计数;
按比例混合类器官与 CAFs,加入 Matrigel 和共培养培养基,制成 50 μL 液滴接种到 24 孔板;
37°C、5% CO₂下固化 30 分钟,加入 0.5 mL 共培养培养基,每 2-3 天换液;
共培养 6 天后,收集培养基、类器官及 CAFs,用于后续检测(如 α-SMA 免疫荧光染色、细胞因子检测等)。
3. 类器官的检测方法
形态学观察
通过倒置显微镜观察类器官的大小、形态及增殖状态,记录生长动力学。
免疫荧光染色
固定类器官后,用抗 Ki-67(增殖标志物)、抗 ULBP2 抗体孵育,荧光二抗显色,DAPI 染核,通过共聚焦显微镜观察蛋白表达与定位。
细胞毒性实验
将 ULBP2 CAR-T 细胞与类器官按不同效靶比(E:T)共培养,通过 LDH 释放法检测类器官杀伤率,计算 CAR-T 细胞的特异性杀伤能力。
二、CAR-T 细胞制备与功能检测技术
1. 抗 ULBP2 单克隆抗体(mAb)的制备
免疫方案
6 周龄 C57BL/6 小鼠经皮下多点注射 1×10⁶稳定表达 ULBP2 的 HEK-293T 细胞,共免疫 3 次;末次免疫后 5 天,用 2×10⁶相同细胞加强免疫。
抗体生产
采用 Microfluid-based Antibody Tech(MBAT)技术,通过脾细胞与骨髓瘤细胞融合制备杂交瘤,筛选特异性识别 ULBP2 的单克隆抗体。
2. ULBP2 CAR 的构建与慢病毒生产
CAR 结构
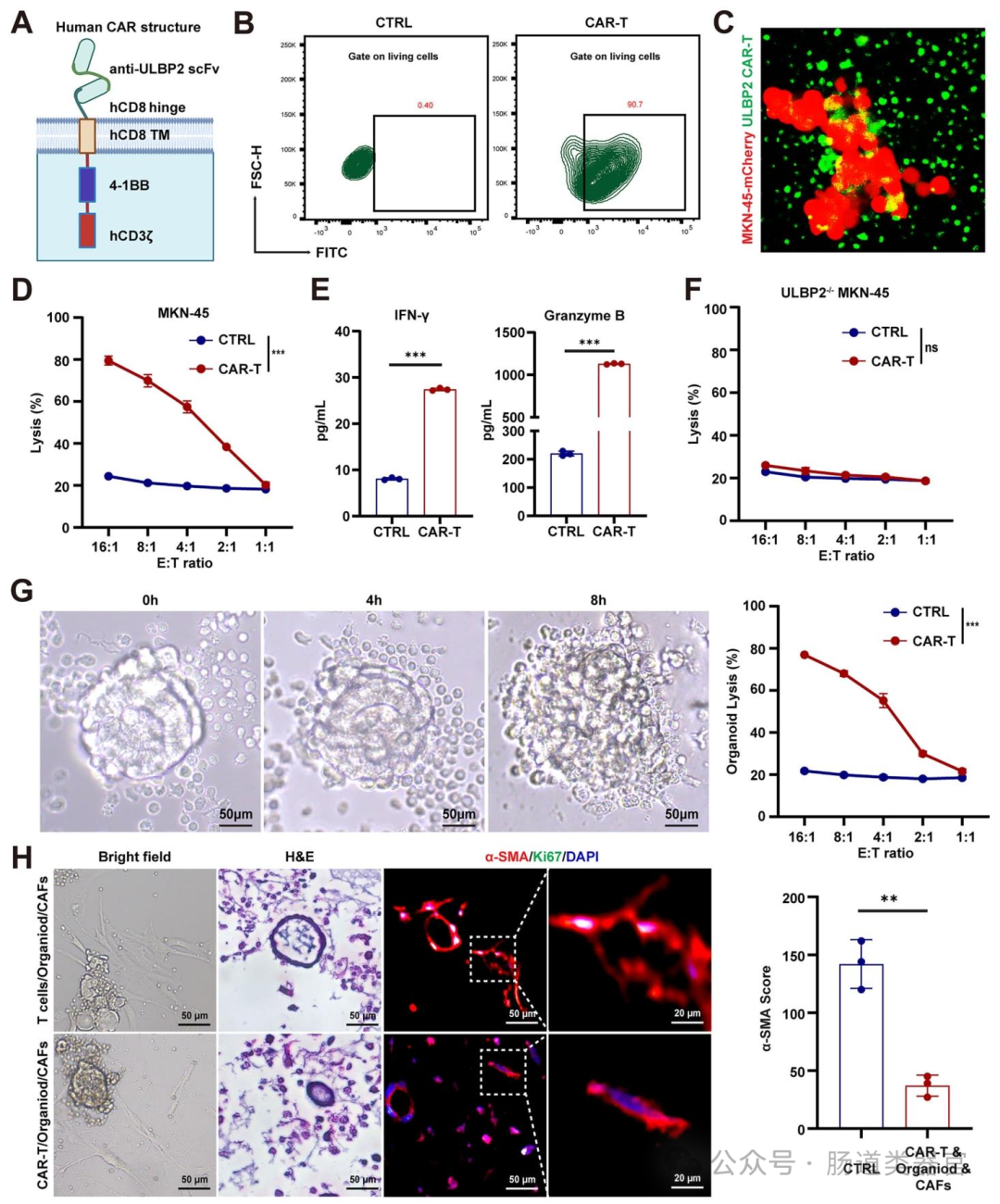
第二代 CAR,包含抗 ULBP2 单链可变片段(scFv)、人 CD8 铰链区和跨膜区、4-1BB 共刺激域、CD3ζ 信号域(图 5A)。
慢病毒生产
关键试剂:HEK-293T 细胞、Lenti-CAR 质粒、psPAX2(包装质粒)、pMD2G(包膜质粒)、Lipofectamine 2000、0.45 μm 滤膜。
步骤:HEK-293T 细胞接种于 10 cm 培养皿,18 小时后按比例共转染 CAR 质粒、psPAX2 和 pMD2G;6 小时后换液,60 小时后收集上清,1000×g 离心 10 分钟去除细胞碎片,0.45 μm 滤膜过滤,浓缩病毒液备用。
3. ULBP2 CAR-T 细胞的制备与功能验证
T 细胞分离
从人外周血单个核细胞(PBMCs)中用 EasySep Human T Cell Isolation Kit(STEMCELL, 17951)富集 CD3⁺ T 细胞。
活化与转导
T 细胞用 CD3/CD28 磁珠(Gibco, 11131D)以 1:2 比例活化,加入 10 ng/mL IL-2;24 小时后加入慢病毒液,32°C、1000×g 离心 90 分钟转导,10 小时后换液。
功能检测
杀伤实验:LDH 法检测 CAR-T 细胞对 ULBP2⁺胃癌细胞系(如 MKN-45)及类器官的杀伤效率(图 5D、G)。
细胞因子检测:ELISA 法检测共培养上清中 IFN-γ 和颗粒酶 B 的浓度,评估 CAR-T 细胞的活化程度(图 5E)。
三、动物模型构建技术
1. 细胞系衍生异种移植(CDX)模型
细胞准备
MKN-45 细胞稳定表达 ULBP2 和萤火虫荧光素酶(MKN-45-ULBP2-T2A-Luc),调整浓度为 3×10⁶ cells/100 μL。
接种与处理
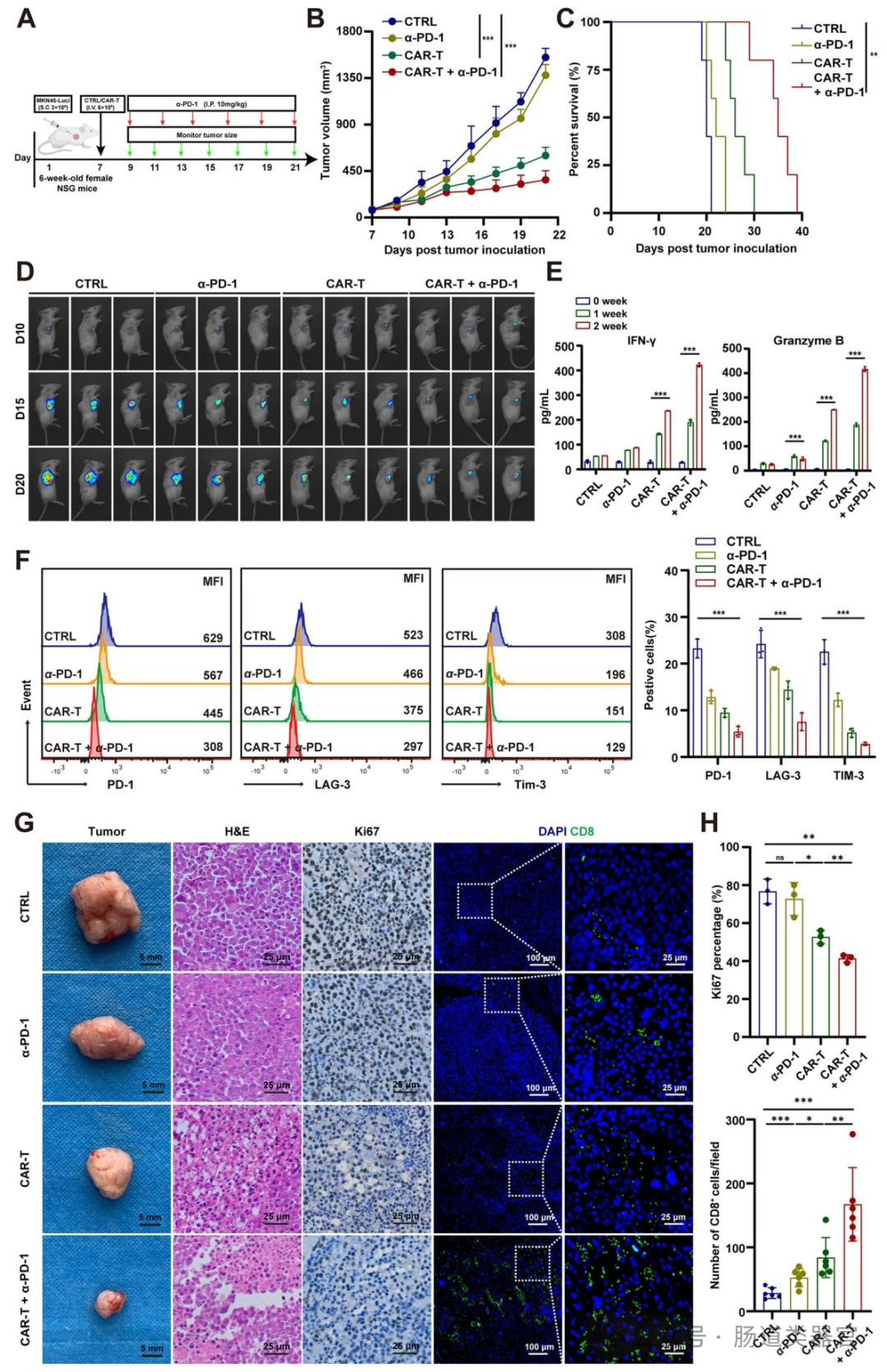
6 周龄 NSG 小鼠右侧皮下注射 100 μL 细胞悬液(含 50% Matrigel);待肿瘤体积达 90 mm³ 时,尾静脉注射 6×10⁶ ULBP2 CAR-T 细胞,联合组每 5 天腹腔注射 10 mg/kg 抗 PD-1 抗体。
监测
通过生物发光成像监测肿瘤生长,定期测量肿瘤体积和小鼠体重,记录生存期(图 6B-D)。
2. 患者来源异种移植(PDX)模型
组织接种
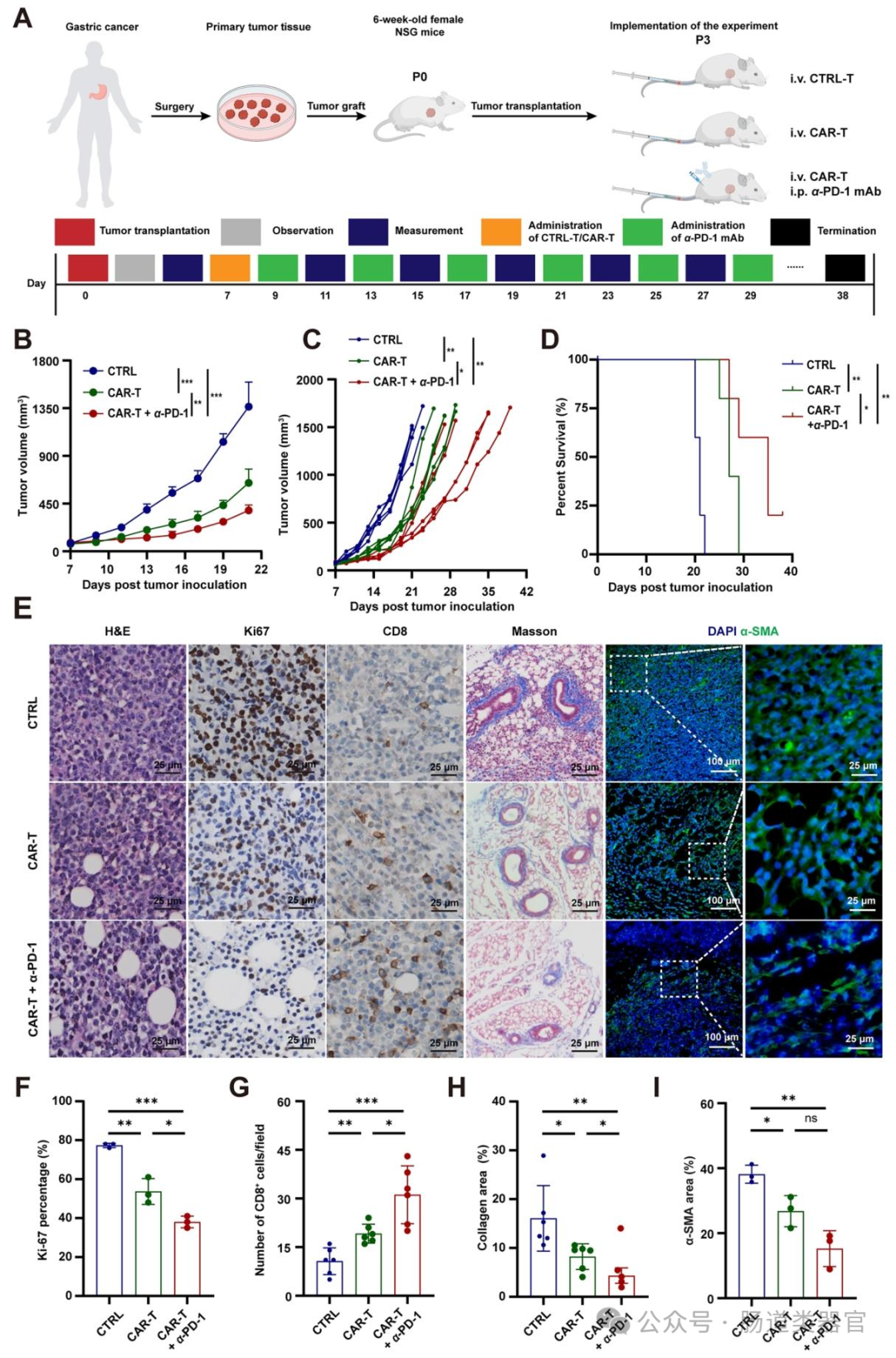
新鲜胃癌组织切成 10 mm³ 小块,皮下接种到 6 周龄 NSG 小鼠,进行 serial transplantation 至第三代(P3)。
治疗与检测
P3 代小鼠肿瘤达 90 mm³ 时,按 CDX 模型方案处理;终点时收集肿瘤组织,进行 HE 染色、Ki-67 免疫组化及 CD8⁺ T 细胞浸润检测(图 7E-G)。
四、分子与细胞生物学检测技术
1. 基因编辑技术(CRISPR/Cas9)
目的
敲除胃癌细胞系(如 SNU-216、MKN-45)中的 ULBP2 基因,研究其功能。
步骤
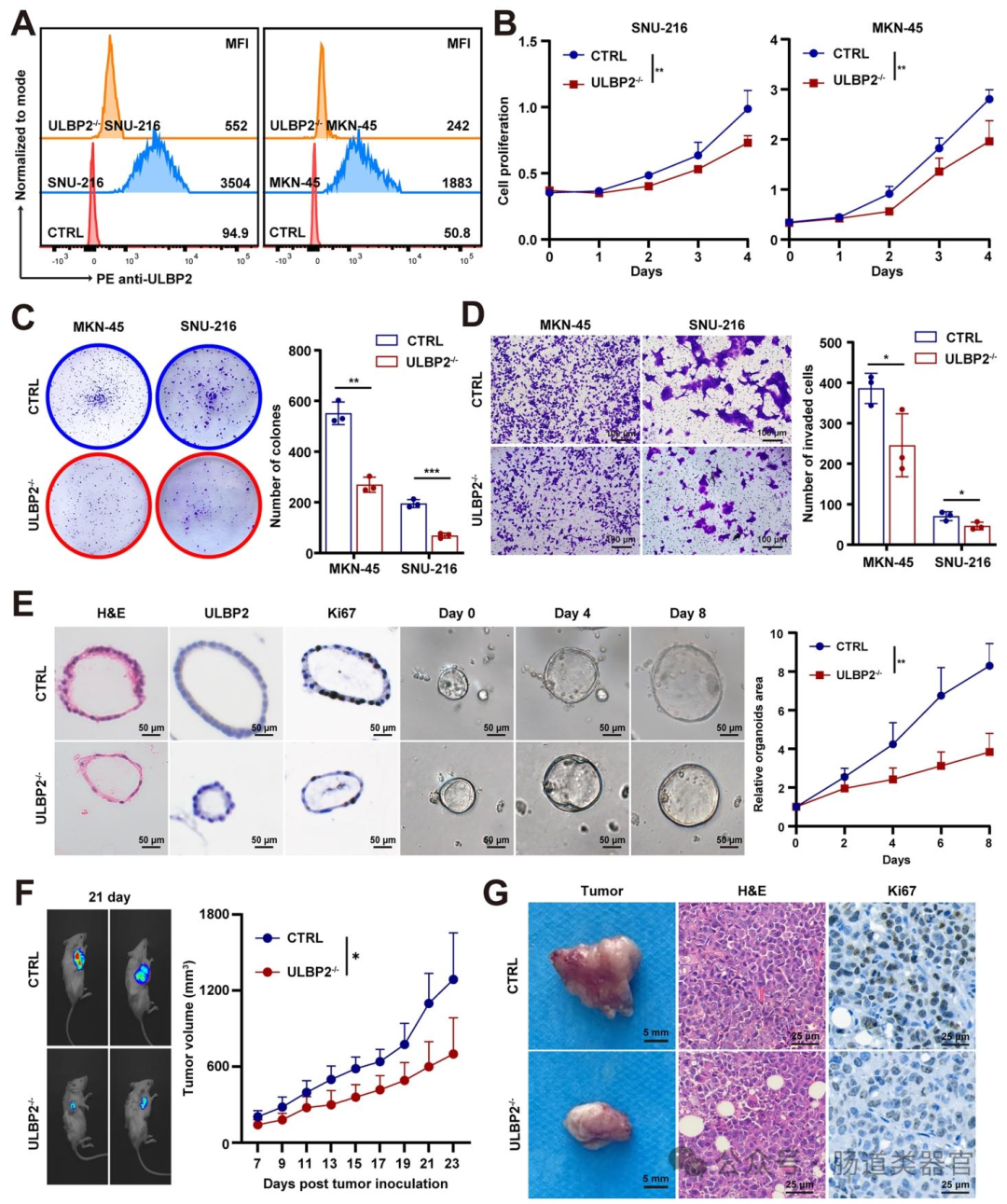
设计 ULBP2 特异性 gRNA(序列见表 S2),构建 pLentiCRISPR-V2 载体;转染胃癌细胞,嘌呤霉素筛选稳定敲除细胞系,通过流式细胞术和 Western blot 验证敲除效率(图 2A)。
2. 转录组与通路分析
RNA 测序
提取 ULBP2 敲除与野生型 MKN-45 细胞的总 RNA,进行转录组测序,筛选差异表达基因(DEGs)。
通路富集
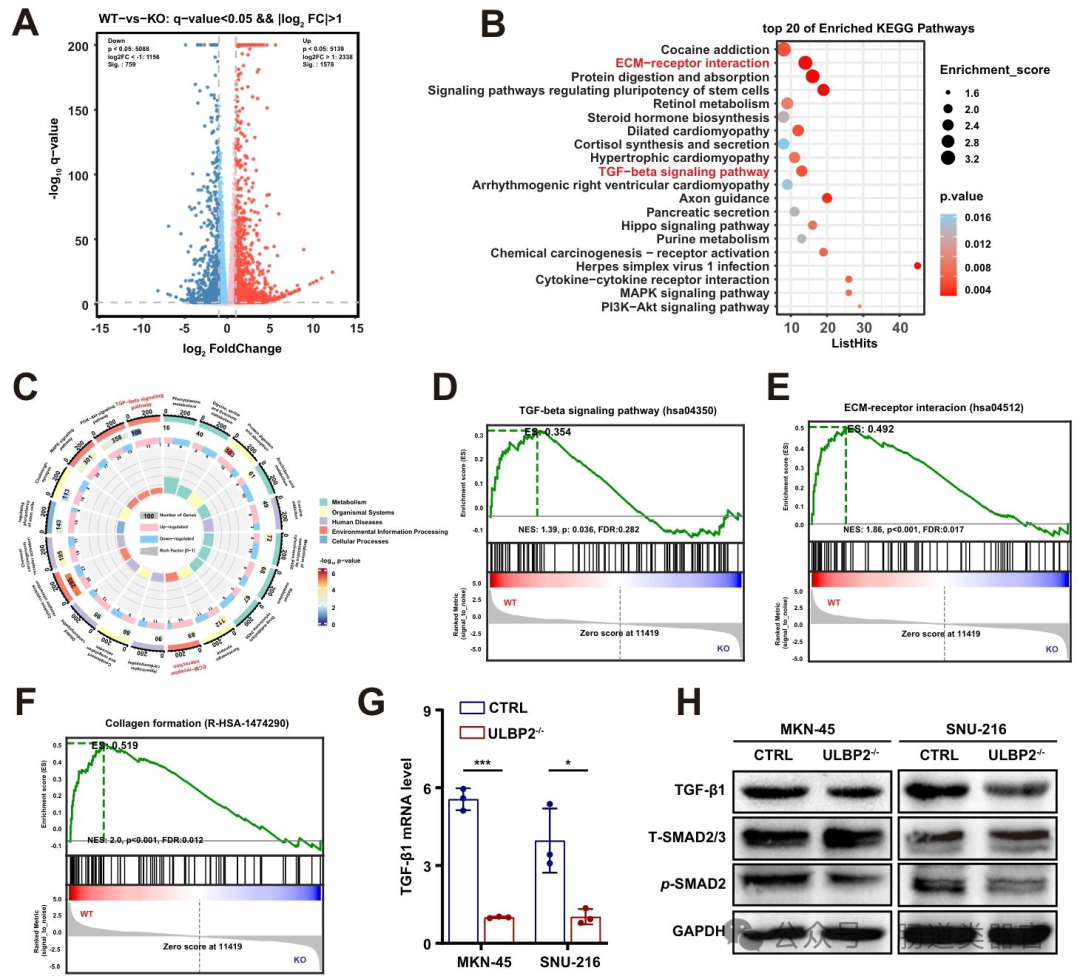
利用 GO 和 KEGG 数据库对 DEGs 进行富集分析,发现 TGF-β 信号通路和 ECM - 受体相互作用是主要受影响的通路(图 3B、C)。
3. 免疫组织化学(IHC)与组织染色
IHC 检测
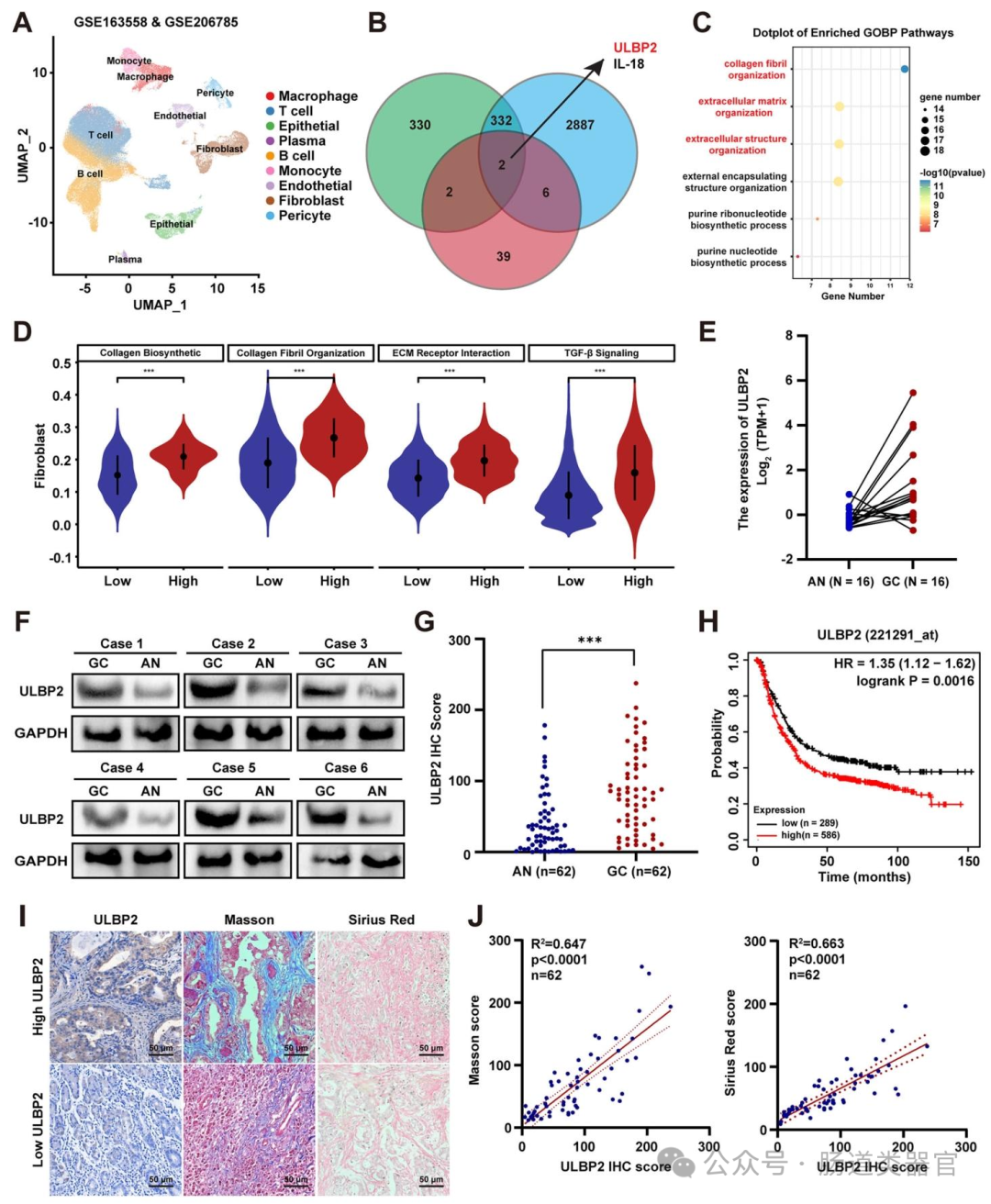
肿瘤组织石蜡切片脱蜡后,用抗 ULBP2、Ki-67、CD8 抗体孵育,DAB 显色,苏木素复染;通过 H-score(染色强度 × 阳性细胞比例)定量蛋白表达(图 1G、7F)。
基质染色
Masson 三色染色和 Sirius 红染色检测肿瘤组织中胶原的沉积量,评估基质致密程度(图 1I、7H)。
科普说明
类器官
一种在体外由干细胞或肿瘤细胞培养形成的 3D 结构,具有与来源器官相似的组织学特征和功能,能更好地模拟体内微环境,是研究肿瘤生物学和药物筛选的理想模型。
CAR-T 细胞
通过基因工程改造的 T 细胞,表达能特异性识别肿瘤抗原的嵌合抗原受体(CAR),可精准杀伤肿瘤细胞,目前在血液肿瘤中疗效显著,本研究探索其在实体瘤(胃癌)中的应用。
PDX 模型
将患者肿瘤组织直接移植到免疫缺陷小鼠体内,保留了原肿瘤的异质性和微环境特征,是评估新疗法临床转化潜力的 “金标准” 模型。
关键结果图表
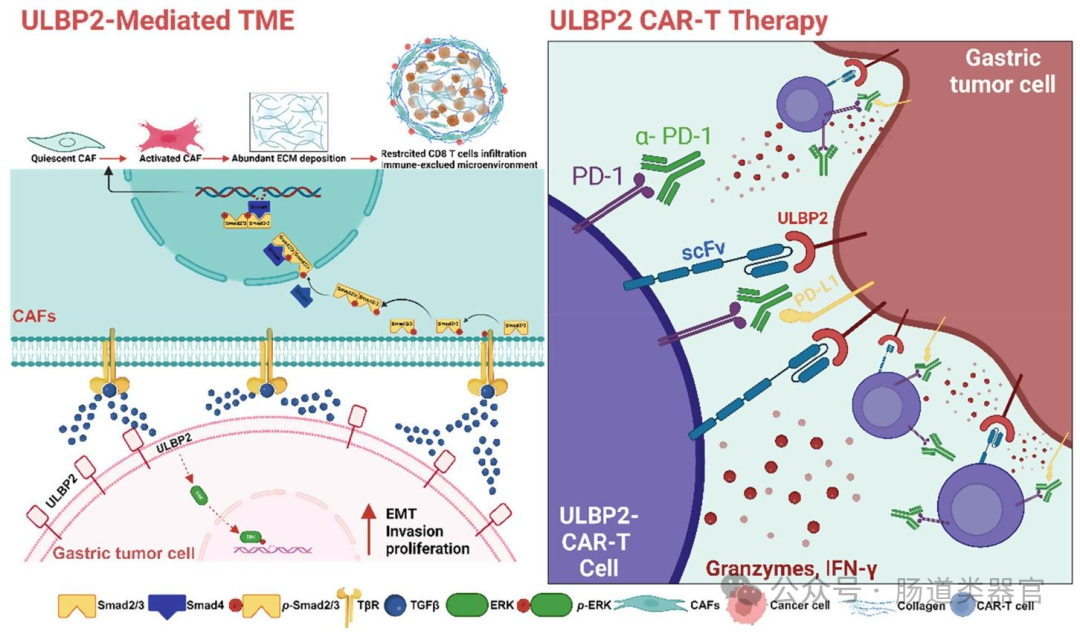
该研究针对胃癌(GC)治疗中存在的致密基质微环境、缺乏有效治疗靶点及 CAR-T 细胞疗法在实体瘤中疗效有限等问题展开,提出猜想:ULBP2 可能通过激活 TGF-β 信号通路促进癌相关成纤维细胞(CAFs)活化,参与胃癌进展,而靶向 ULBP2 的 CAR-T 细胞或许能有效抑制胃癌,联合抗 PD-1 抗体可增强疗效。
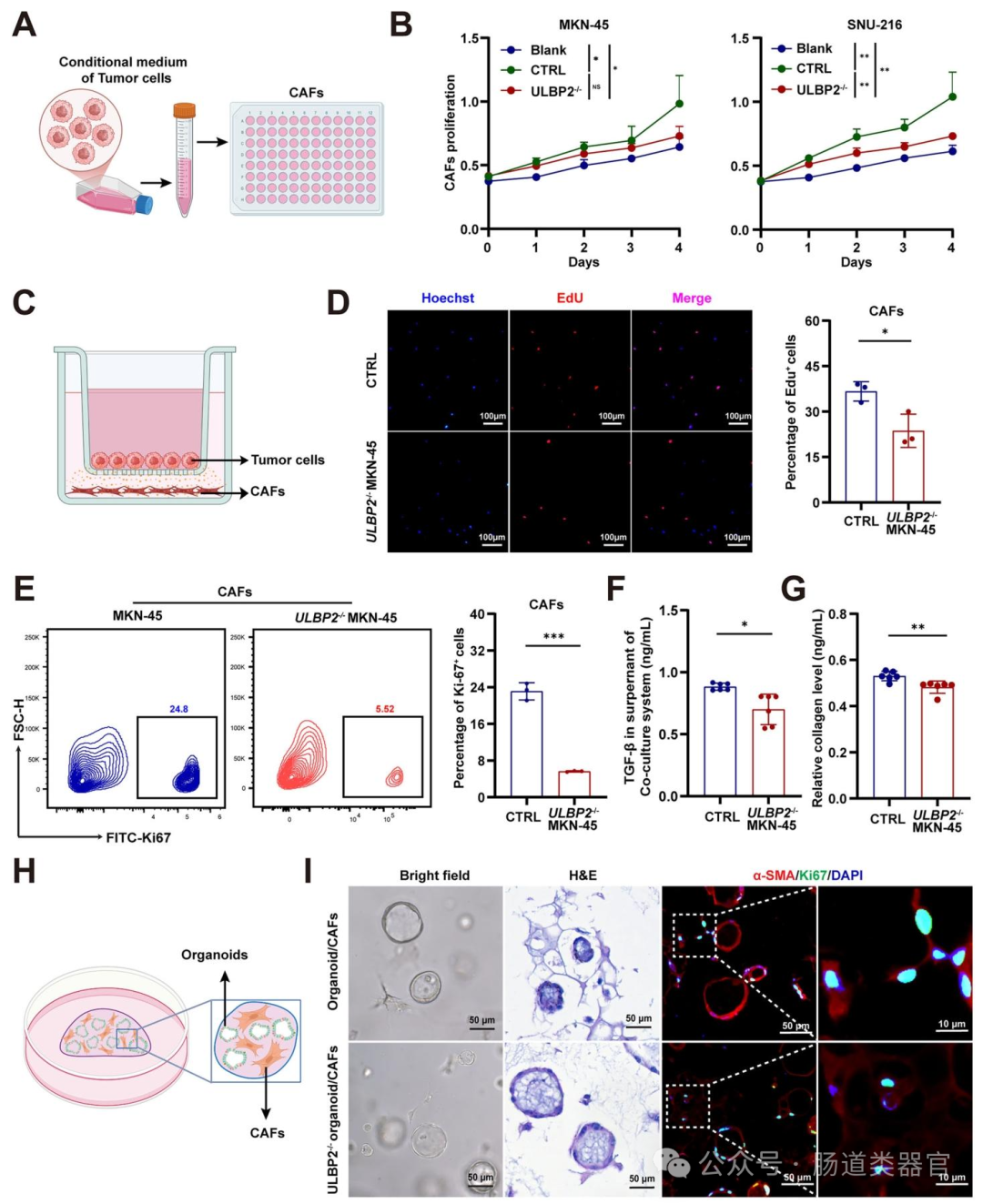
为验证上述猜想,研究者首先通过 mRNA 芯片和单细胞 RNA 测序(scRNA-seq)分析,对比 16 例胃癌患者肿瘤与邻近正常组织的差异表达基因,结合 ECM 相关基因和免疫相关基因筛选,发现 ULBP2 在胃癌中高表达且与 ECM 通路相关(图 1A、B)。随后,通过 Western blot、免疫组织化学(IHC)等实验,证实 ULBP2 在胃癌组织中 mRNA 和蛋白水平均显著升高,且高表达与更差的总生存期(OS)及胶原沉积正相关(图 1E-J)。为探究 ULBP2 的功能,研究者利用 CRISPR/Cas9 技术在 SNU-216 和 MKN-45 细胞中敲除 ULBP2,发现其显著降低细胞增殖、侵袭和迁移能力,诱导凋亡;而过表达 ULBP2 则促进 AGS 和 HGC-27 细胞的恶性表型,在类器官模型中也观察到类似结果(图 2B-E),动物实验中 ULBP2 敲除的 MKN-45 细胞在细胞系衍生异种移植(CDX)模型中生长更慢(图 2F-G)。
进一步探究机制时,转录组分析显示 ULBP2 敲除显著影响 TGF-β 信号通路和 ECM - 受体相互作用(图 3B、C),qRT-PCR 和 Western blot 证实 ULBP2 敲除降低 TGF-β1 mRNA 及蛋白水平,减少 SMAD2 磷酸化(图 3G-H),且影响上皮间质转化(EMT)相关分子表达。通过条件培养基和 Transwell 共培养实验,发现 ULBP2 敲除的胃癌细胞上清液显著抑制 CAF 增殖,减少 TGF-β 和胶原水平(图 4B-G),类器官与 CAF 共培养显示 ULBP2 敲除抑制 α-SMA 活化(图 4H-I),表明 ULBP2 通过 TGF-β 通路促进 CAF 活化和基质沉积。
在治疗策略方面,研究者构建了第二代 ULBP2 CAR-T 细胞(含抗 ULBP2 scFv、CD8 铰链、4-1BB 共刺激域和 CD3ζ 信号域),转导效率达 90.7%(图 5B),其能特异性识别并杀伤 ULBP2⁺胃癌细胞(MKN-45、SNU-216)及患者来源类器官,释放 IFN-γ 和颗粒酶 B(图 5D-G),且在类器官与 CAF 共培养中抑制 CAF 活化(图 5H)。动物实验中,ULBP2 CAR-T 细胞在 CDX 模型中单独或联合抗 PD-1 均显著抑制肿瘤生长,延长生存期,增加血清中 IFN-γ 和颗粒酶 B 水平,减少 T 细胞耗竭标志物(PD-1、LAG-3、TIM-3)表达(图 6B-F);在患者来源异种移植(PDX)模型中,联合治疗显著延长生存期,增加 CD8⁺T 细胞浸润,减少基质沉积和 CAF 活化(图 7B-I),且无严重细胞因子释放综合征(CRS)。
总结与结论:该研究证实 ULBP2 在胃癌中高表达,通过激活 TGF-β 信号通路促进 CAF 活化和胶原沉积,形成致密基质微环境,促进肿瘤进展;开发的 ULBP2 CAR-T 细胞能特异性杀伤胃癌细胞和类器官,单独或联合抗 PD-1 在 CDX 和 PDX 模型中显著抑制肿瘤生长,延长生存期,为胃癌治疗提供了新靶点和联合策略。未来可进一步探索 ULBP2 CAR-T 在临床中的剂量优化、与其他疗法的联合效果,以及 ULBP2 调控 TGF-β 通路的更精细机制等问题。
特色与创新之处
该研究在胃癌免疫治疗领域展现出多方面特色与创新,具体如下:
其一,识别 ULBP2 作为胃癌新的特异性治疗靶点。研究通过 mRNA 芯片、单细胞 RNA 测序及临床样本验证,发现 ULBP2 在胃癌组织中显著高表达,而在正常组织中几乎不表达,且其高表达与患者不良预后及胶原沉积密切相关。这一发现突破了现有胃癌治疗靶点(如 CLDN18.2)的局限,为胃癌的精准靶向治疗提供了新的特异性分子,其组织表达的特异性也降低了治疗相关毒副作用的潜在风险。
其二,揭示 ULBP2 调控胃癌致密基质微环境的全新机制。研究首次证实,ULBP2 通过激活 TGF-β 信号通路,促进癌相关成纤维细胞(CAFs)活化及胶原沉积,进而形成不利于免疫细胞浸润的致密基质微环境。这一机制将 ULBP2 的 oncogenic 作用与肿瘤微环境重塑关联,深化了对胃癌进展中 “肿瘤细胞 - 基质细胞” 相互作用的理解,为通过靶向分子打破基质屏障、改善免疫治疗响应提供了理论依据。
其三,开发 ULBP2 CAR-T 细胞疗法并验证其协同抗 PD-1 的增效价值。研究构建了基于抗 ULBP2 单克隆抗体的第二代 CAR-T 细胞,该细胞能特异性识别并杀伤 ULBP2 阳性胃癌细胞及患者来源类器官,且在细胞系衍生异种移植(CDX)和患者来源异种移植(PDX)模型中,单独或与抗 PD-1 联合使用均显著抑制肿瘤生长、延长生存期。尤为重要的是,联合治疗可减少 T 细胞耗竭标志物(PD-1、LAG-3、TIM-3)的表达,增加 CD8⁺T 细胞浸润,这为实体瘤中 CAR-T 与免疫检查点抑制剂的协同应用提供了新范式。
其四,多维度模型验证提升研究的临床转化价值。研究结合胃癌细胞系、患者来源类器官、CDX 模型及 PDX 模型,从体外到体内、从标准化模型到临床相关性更高的个体化模型,系统验证了 ULBP2 的作用及 ULBP2 CAR-T 的疗效。特别是患者来源类器官和 PDX 模型的应用,最大限度保留了肿瘤的异质性和微环境特征,使研究结果更贴近临床实际,为后续临床转化奠定了坚实基础。
其五,证实 ULBP2 CAR-T 对肿瘤微环境的调节作用。不同于传统 CAR-T 仅靶向杀伤肿瘤细胞的单一机制,该研究发现 ULBP2 CAR-T 细胞还能减少基质沉积、抑制 CAF 活化,改善肿瘤微环境的免疫抑制状态。这一 “双重作用”(直接杀伤肿瘤细胞 + 调节微环境)提升了 CAR-T 在实体瘤中的治疗潜力,为解决实体瘤中 CAR-T 疗效受限的难题提供了新思路。
可以改进的地方[AI基于大数据总结,仅供参考]
该研究虽在胃癌靶向治疗领域取得重要进展,但仍存在以下不足,结合研究实际可从多方面优化完善:
其一,动物模型的免疫环境模拟有限。研究采用的 NSG 小鼠(NOD-Prkdc scid / Il2rg^em1)缺乏成熟 T、B 和 NK 细胞,虽能支持异种移植,但无法完全模拟人类免疫系统的复杂性。这导致 CAR-T 细胞在体内的存活、扩增及与宿主免疫细胞的交互作用难以真实反映临床情况,例如细胞因子释放综合征(CRS)的潜在风险可能被低估 —— 研究中虽未观察到严重 CRS,但在更接近人类免疫环境的模型中可能呈现不同结果。建议后续使用人源化小鼠模型(如 NSG-SGM3,具备功能性髓系细胞和 NK 细胞),更精准评估 CAR-T 的安全性及与内源性免疫的协同效应。
其二,ULBP2 调控 TGF-β 通路的分子机制尚未完全阐明。研究证实 ULBP2 敲除可降低 TGF-β1 表达及 SMAD2 磷酸化,但未明确 ULBP2 与 TGF-β 通路的直接分子互作(如是否通过结合 TGF-β 受体或上游调控因子发挥作用)。此外,ULBP2 作为 GPI 锚定蛋白,其胞外域是否通过旁分泌或自分泌方式影响 CAF 活化,仍缺乏直接证据。建议通过免疫共沉淀、表面等离子体共振(SPR)等技术验证 ULBP2 与 TGF-β 通路关键分子的结合,结合磷酸化蛋白组学解析下游信号级联,明确其调控的具体节点。
其三,CAR-T 细胞的体内持久性与肿瘤微环境适应能力数据不足。研究提到 CAR-T 细胞在小鼠体内有扩增,但未提供长期(如超过 4 周)的存活及功能状态跟踪。实体瘤微环境中的免疫抑制因子(如 IL-10、TGF-β)可能导致 CAR-T 细胞耗竭,而研究中仅检测了治疗后 21 天的耗竭标志物(PD-1、LAG-3 等),长期持久性数据的缺失限制了对治疗效果稳定性的评估。建议延长动物实验周期,通过流式细胞术动态监测 CAR-T 细胞的比例、表型(如 CD4/CD8 比例、记忆细胞标志物)及细胞因子分泌能力,同时检测肿瘤微环境中代谢物(如腺苷、乳酸)对 CAR-T 功能的影响。
其四,患者样本的异质性覆盖不足。研究中类器官、PDX 模型主要来自少数患者(如 PDX 模型仅提及 1 例患者样本),且未按胃癌亚型(如弥漫型、肠型)或分子分型(如 EBV 阳性、微卫星不稳定型)分层分析。胃癌的高度异质性可能导致不同亚型对 ULBP2 CAR-T 的响应存在差异,而现有数据难以支撑对不同患者群体的疗效预测。建议扩大患者样本量(至少纳入 10 例以上不同亚型患者),通过单细胞测序分析不同亚型中 ULBP2 的表达模式及与疗效的关联,明确 ULBP2 CAR-T 的适用人群。
其五,联合治疗的协同机制解析不充分。研究显示 ULBP2 CAR-T 与抗 PD-1 联合可增强疗效,但未明确协同作用的核心机制:是 CAR-T 细胞减少导致免疫抑制的 CAF,间接增强抗 PD-1 的响应;还是通过上调 CD8⁺T 细胞的效应功能,或下调肿瘤细胞 PD-L1 表达?虽检测到 CD8⁺T 细胞浸润增加和耗竭标志物减少,但缺乏对免疫检查点分子(如 PD-L1、CTLA-4)表达变化及细胞因子(如 IL-2、IFN-γ)网络的系统分析。建议通过流式细胞术检测肿瘤细胞和免疫细胞表面 PD-L1 的表达,结合 RNA 测序分析联合治疗后免疫相关通路的富集情况,明确协同作用的关键分子机制。
综上,通过优化动物模型、深化分子机制、扩大样本覆盖及解析协同机制,可进一步提升研究的临床转化价值,为胃癌精准免疫治疗提供更坚实的理论和实验依据。
该研究明确 UL16 结合蛋白 2(ULBP2)为胃癌潜在治疗靶点,揭示其通过激活转化生长因子 -β(TGF-β)信号通路促进癌相关成纤维细胞(CAFs)活化及肿瘤进展的机制。开发的 ULBP2 CAR-T 细胞能有效清除胃癌细胞和类器官,单独或联合抗 PD-1 抗体在细胞系及患者来源异种移植模型中显著抑制肿瘤生长、延长生存期,减少基质沉积并促进 T 细胞浸润。为胃癌免疫治疗提供新靶点与联合策略,对实体瘤 CAR-T 疗法发展具重要参考价值。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


