Cell Res:同济大学章小清/刘玲团队开发新型疫苗,让器官移植不再排斥
来源:生物世界 2025-01-08 13:52
结果显示,供体 MHC 特异性胸腺疫苗接种(DMTV)策略是在受体中引入供体相容免疫系统的有效途径,有望克服治疗终末期器官衰竭患者的 MHC 匹配的供体器官极度短缺的临床困境。
同济大学附属东方医院章小清、刘玲等人在 Cell Research 期刊发表了题为:Donor MHC-specific thymus vaccination allows for immunocompatible allotransplantation 的研究论文。
该研究开发了一种供体 MHC 特异性胸腺疫苗接种(donor MHC-specific Thymus Vaccination,DMTV)策略,可诱导异基因移植免疫耐受,有望克服治疗终末期器官衰竭患者的 MHC 匹配的供体器官极度短缺的临床困境。

T 细胞在移植排斥反应过程中发挥核心作用。T 细胞区分 MHC 不匹配的“非自身”细胞和 MHC 匹配的“自身”细胞的特征是在胸腺发育过程中获得的。在胸腺中,未成熟的 T 细胞(胸腺细胞)会经历正负选择。在正向选择过程中,当胸腺上皮细胞(TEC)和树突状细胞(DC)表面表达的 MHC 与 T 细胞表面的 T 细胞受体(TCR)之间亲和力较低时,T 细胞会因被忽视而发生凋亡。那些 T 细胞在阴性选择期间也会被编程进行细胞凋亡,当未成熟的 T 细胞上的 TCR 与 MHC 或呈递的抗原肽以高亲和力结合时,以防止自身免疫反应。
在这项最新研究中,研究团队开发了一种供体 MHC 特异性胸腺疫苗接种(donor MHC-specific Thymus Vaccination,DMTV)策略,以重现胸腺中 T 细胞发育过程中的 TCR-MHC 适应。
研究团队推测,异基因 MHC(MHCallo)在受体胸腺的胸腺上皮细胞(TEC)和树突状细胞(DC)中的异位表达,将通过在阳性和阴性选择期间特异性清除供者反应性 T 细胞来驱动“非自身”T细胞向“自身”T细胞抗原识别。接受 DMTV 的受者预期对携带接种 MHC 的等位变异的供者器官或组织的同种异体移植耐受,而不需要使用免疫抑制剂。
具体来说,研究团队通过腺相关病毒(AAV)递送,在受体胸腺中表达了同种异体 MHC 分子,这使得同种异体 MHC 与自体 MHC 在工程化胸腺中得以稳定表达。在局部 T 细胞教育过程中,识别自体 MHC 或同种异体 MHC 的 T 细胞均被同等程度地清除。
通过将 C57BL/6-MHC 的胸腺组织移植到 BALB/c 小鼠胸腺中,构建了 C57BL/6-MHC 和 BALB/c-MHC 双免疫兼容小鼠,并观察到在将 C57BL/6 皮肤和 C57BL/6 小鼠胚胎干细胞移植到接种过的 BALB/c 小鼠体内后的长期移植物耐受现象。研究团队还在骨髓、肝脏和胸腺(BLT)人源化小鼠模型中验证了 DMTV 策略,用于免疫相容性的人胚胎干细胞同种异体移植。
结果显示,供体 MHC 特异性胸腺疫苗接种(DMTV)策略是在受体中引入供体相容免疫系统的有效途径,有望克服治疗终末期器官衰竭患者的 MHC 匹配的供体器官极度短缺的临床困境。
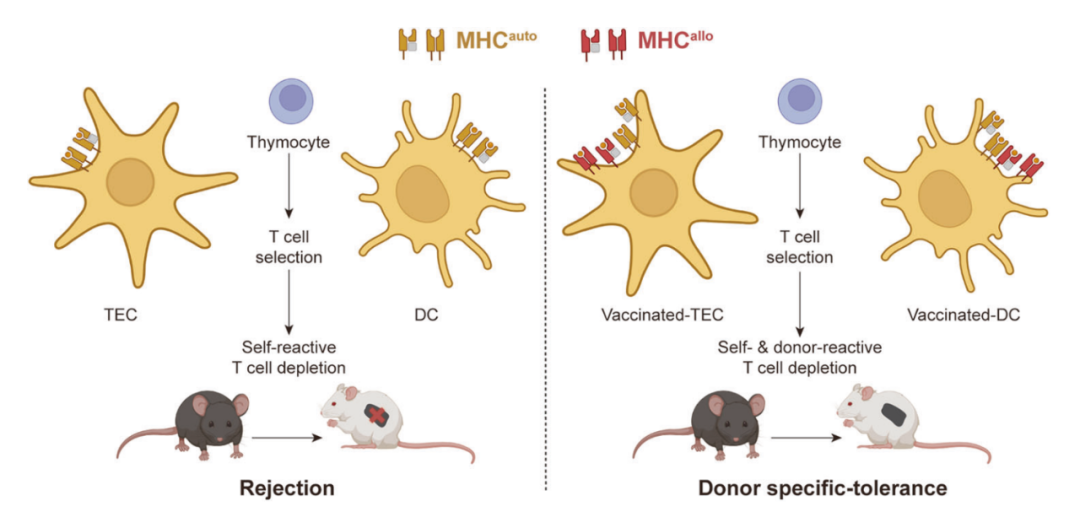
供体MHC特异性胸腺疫苗接种诱导的异基因移植免疫耐受
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


