2020年9月Science期刊不得不看的亮点研究
来源:本站原创 2020-09-30 23:58
2020年9月30日讯/生物谷BIOON/---2020年9月份即将结束了,9月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2020年9月30日讯/生物谷BIOON/---2020年9月份即将结束了,9月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:深入分析人体对新冠病毒的抗体反应,为开发新的更有效疫苗奠定基础
doi:10.1126/science.abd4250
一种旨在从一滴血中检测病毒感染史的工具在COVID-19时代得到了升级。VirScan是一种可以确定1000多种不同病毒中哪些病毒感染过人的技术,如今还可以检测出包括SARS-CoV-2在内的冠状病毒的感染证据。在一项新的研究中,来自美国布莱根妇女医院和哈佛医学院的研究人员提供了大量关于人类对SARS-CoV-2的抗体反应的细节,以及这种反应在感染了更严重的COVID-19的个体中可能有什么不同。相关研究结果于2020年9月29日在线发表在Science期刊上,论文标题为“Viral epitope profiling of COVID-19 patients reveals cross-reactivity and correlates of severity”。

在分析中,Elledge及其同事们通过使用VirScan分析了232名COVID-19患者和190名对照者在COVID-19出现前的血液样本,深入研究了对SARS CoV-2的抗体反应。他们确定了免疫系统可以识别的800个称为表位(epitope)的病毒位点。并非所有的表位都是一样的,有些表位可能被中和抗体识别,从而引起消除感染的反应。然而,如果身体产生了针对其他表位的抗体,它可能会启动一个不太有效的反应,从而让这种病毒占据优势。在某些情况下,包括SARS-CoV病毒在内的病毒甚至能够从身体的抗体反应中获益,利用抗体进入细胞,这种现象被称为抗体依赖性增强作用(antibody-dependent enhancement)。
就SARS-CoV-2而言,Elledge团队检测到了一系列针对不同表位的抗体频率。许多表位是公共表位(public epitope)---被大量患者的免疫系统识别的区域。其中的一个公共表位被79%的COVID-19患者识别。其他的表位被认为是私有的,只被少数人甚至一个人的免疫系统识别。10个表位存在于这种病毒进入宿主细胞所必需的关键区域,可能被中和抗体识别。该团队利用最具鉴别力的表位开发了一种快速诊断测试方法。
2.Science:重大进展!揭示内质网P5A-ATPase是一种跨膜螺旋脱位酶
doi:10.1126/science.abc5809
在一项新的研究中,作为一种研究膜蛋白定位的模型,来自美国哈佛医学院和加州大学伯克利分校的研究人员着重关注尾锚定蛋白(tail–anchored protein),尾锚定蛋白含有的单个C端跨膜区对细胞器定位是必要的,并且在很大程度上是充分的。他们推断,介导线粒体尾锚定蛋白定位的因子会直接与新生蛋白相互作用。
这些作者使用了一种无偏见的、位点特异性的交联和质谱方法来鉴定这样的蛋白跨膜区。这种方法揭示了内质网驻留的孤儿P型泵P5A-ATP酶(酵母中的Spf1;人类中的ATP13A1)直接与线粒体尾锚定蛋白相互作用。
由于遗传学研究已经将P5A-ATP酶(P5A-ATPase)与线粒体尾锚定蛋白错位联系起来,这些作者结合生化和结构方法来确定P5A-ATP酶的功能和机制。相关研究结果发表在2020年9月25日的Science期刊上,论文标题为“The endoplasmic reticulum P5A-ATPase is a transmembrane helix dislocase”。
这些作者将P5A-ATP酶的功能确定为内质网膜上跨膜区的脱位酶(dislocase)。这种功能分配表明P型ATP酶除了转运离子和脂质之外,还转运底物。P5A-ATP酶积极地将错误插入的蛋白从内质网中移出,也代表了一种以前未知的细胞保障和质量控制机制,有助于维持内质网和线粒体稳态,这也可能解释了与P5A-ATP酶功能障碍相关的多效表型。
3.两篇Science论文揭示曼氏血吸虫的弱点,有助开发治疗血吸虫病的新药物
doi:10.1126/science.abb7709; doi:10.1126/science.abb7699; doi:10.1126/science.abe0710
在来自美国德克萨斯大学西南医学中心的研究人员的领导下,两项新的研究阐明了血吸虫---引起鲜为人知的热带疾病血吸虫病的寄生性扁虫---的生物学特性和潜在的弱点。这一发现可能会改变这种每年导致高达25万人死亡的疾病的进程。相关研究结果发表在2020年9月25日的Science期刊上,论文标题分别为“A single-cell RNA-seq atlas of Schistosoma mansoni identifies a key regulator of blood feeding”和“Large-scale RNAi screening uncovers therapeutic targets in the parasite Schistosoma mansoni”。 在第一项研究中,这些研究人员深入研究了构成这种扁虫的细胞类型。虽然这种扁虫是由多种独特的组织类型组成的多细胞生物,但是人们对它的不同细胞群体知之甚少。
为了构建曼氏血吸虫(Schistosoma mansoni)---通常导致血吸虫病的血吸虫种类之一---的细胞类型图谱,Collins和他的团队使用了一种名为单细胞RNA测序的技术,该技术可以根据独特的基因表达模式区分单个细胞类型。通过这种方法,他们确定了68个分子上独特的细胞簇,包括形成肠道的干细胞群体。当这些研究人员使用一种名为RNA干扰(RNAi)的靶向方法来关闭这些细胞中一个关键基因的激活时,由此产生的血吸虫无法消化红细胞--这是它们生长的关键,也是它们引起病理的关键部分。
在第二项研究中,这些研究人员利用RNAi梳理出曼氏血吸虫中大约20%的蛋白编码基因的功能,其中曼氏血吸虫共有2216个蛋白编码基因。此前,只对这种生物中的少数基因进行了评估。
通过逐一地让这些基因失活,Collins和他的同事们发现了250多个对生存至关重要的基因。然后,这些研究人员利用药理化合物数据库,寻找有可能作用于这些基因产生的蛋白的药物,鉴定出几种对这种寄生虫有活性的化合物。他们还发现了两种蛋白激酶---一组以能够被药物靶向而闻名的蛋白---TAO和STK25对肌肉功能至关重要。当这两种激酶遭受抑制后,这种寄生虫变得瘫痪并最终死亡,这表明靶向这两种激酶的药物最终有可能治疗血吸虫病患者。下一步的研究将是寻找这些蛋白的抑制剂。
4.Science:揭示哺乳动物线粒体复合物I的作用机制
doi:10.1126/science.abc4209
线粒体是我们细胞的能量工厂,它产生的能量支撑着生命。一种称为复合物I(complex I)的巨型分子质子泵至关重要:它启动了一连串的反应,构建出质子梯度来驱动ATP产生。尽管复合物I发挥着核心作用,但是它跨膜运输质子的机制至今仍不为人所知。
如今,在一项新的研究中,奥地利科学技术研究所的Leonid Sazanov及其研究团队破解了复合物I的工作原理之谜:它的构型变化与静电波相结合,将质子移入线粒体基质中。相关研究结果于2020年9月24日在线发表在Science期刊上,论文标题为“The coupling mechanism of mammalian respiratory complex I”。
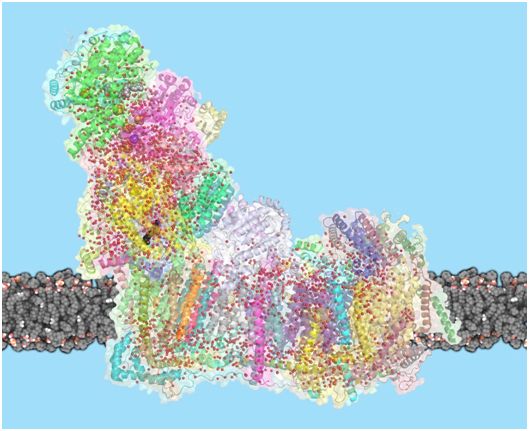
复合物I是呼吸链中的第一个酶。呼吸链由线粒体内膜中的一系列蛋白复合物组成,负责细胞的大部分能量生产。在呼吸链中,三种膜蛋白建立了质子梯度,将质子从细胞质中移入线粒体基质。驱动这个过程的能量主要来自于NADH分子(来源于我们吃的食物)和我们呼吸的氧气之间的电子转移。ATP合酶是呼吸链中的最后一个蛋白,利用这种质子梯度产生ATP。
5.Science:超强效抗体混合物阻断新冠病毒附着宿主细胞
doi:10.1126/science.abe3354
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,来自美国、法国、比利时和意大利的研究人员发现来自康复的COVID-19患者的超强效抗体(ultrapotent antibody)混合物可识别和封锁这种大流行冠状病毒的感染复合体(infection machinery),并阻止它进入细胞。每种类型的超强效抗体发挥的作用存在重叠,但是也略有不同。低剂量的这些超强效抗体,不管是单独使用还是混合在一起使用,都可以阻止SARS-CoV-2在肺部中复制,因而保护仓鼠在暴露于这种病毒时免受感染。相关研究结果于2020年9月24日在线发表在Science期刊上,论文标题为“Ultrapotent human antibodies protect against SARS-CoV-2 challenge via multiple mechanisms”。
这种抗体混合物的一个优点是,它们也可能防止在这次大流行期间这种冠状病毒出现的自然突变体形式逃避治疗。由于在这次冠状病毒大流行期间已在它的感染复合体中发现了一些突变体,使用抗体混合物可以中和一系列这样的病毒突变体。
6.Science:揭示HDAC6介导NLRP3和pyrin炎性体激活机制
doi:10.1126/science.aas8995
典型炎性体是一种多组分蛋白复合物,通过活化caspase-1,在对感染和危险的免疫监控中发挥关键作用。活化的caspase-1裂解白细胞介素1(IL-1)和成孔蛋白gasdermin D,从而导致细胞因子成熟和细胞焦亡。核苷酸结合结构域、富含亮氨酸的重复序列和含热蛋白(pyrin)结构域的蛋白3(NLRP3)可被尼日利亚菌素nigericin)、细胞外ATP和尿酸单钠(MSU)晶体、明矾、二氧化硅和淀粉样蛋白等各种微粒激活,而pyrin炎性体可被艰难梭菌毒素B的Rho-葡糖基化活性所刺激。炎性体激活的一个重要特征是每个细胞形成单个超分子点状物(也称为斑点)。然而,这类点状物的位置和转运仍然是未知的。
在一项新的研究中,为了破解巨噬细胞中炎性体组装和激活的部位和分子机制,来自美国哈佛医学院、波士顿儿童医院、密歇根大学、马萨诸塞大学、中国中南大学、挪威科技大学和德国波恩大学的研究人员通过细胞成像,辅以细胞和小鼠中的药物抑制和靶向剔除,可视化观察炎性体组装。相关研究结果发表在2020年9月18日的Science期刊上,论文标题为“HDAC6 mediates an aggresome-like mechanism for NLRP3 and pyrin inflammasome activation”。
这项研究揭示了HDAC6依赖性的NLRP3和pyrin炎性体组装与MTOC中的聚集体(aggresome)形成之间存在着意想不到的平行关系,所形成的聚集体可用于泛素化病理聚集物的自噬降解。NLRP3和pyrin炎性体的MTOC定位所发挥的双重激活和抑制作用可能是实现炎性体平衡调节的关键。
7.Science:不同的生化反应速度导致物种特异性的分节时钟周期
doi:10.1126/science.aba7668; doi:10.1126/science.abe0953
在一项新的研究中,来自日本理化学研究所、京都大学、西班牙欧洲分子生物学实验室和庞培法布拉大学的研究人员发现“分节时钟(segmentation clock)”---一个控制胚胎体型形成的基因网络---在人类中的进展速度比在小鼠中更慢,原因在于人类细胞中的生化反应更慢。生化反应速度的差异可能是物种间发育节奏差异的基础。相关研究结果发表在2020年9月18日的Science期刊上,论文标题为“Species-specific segmentation clock periods are due to differential biochemical reaction speeds”。
在脊椎动物发育的早期阶段,胚胎发育成一系列的“分节(segment)”,最终分化成不同类型的组织,比如肌肉或肋骨。众所周知,这个过程是由一个振荡的生化过程(即所谓的分节时钟)控制的,分节时钟在不同的物种之间是不同的。例如,小鼠的分节时钟约为2小时,人类约为5小时。然而,为什么这个分节时钟周期的长度在不同物种之间会有所不同,一直是个谜。
他们研究了HES7蛋白的降解率等因素是否存在差异,毕竟HES7蛋白是分节时钟周期中的一个重要因素。他们观察了包括小鼠和人类蛋白降解速度在内的一系列过程,证实了这一假设:两种蛋白在人类细胞中的降解速度都比小鼠细胞慢。此外,HES7转录和翻译成蛋白所需的时间,以及HES7内含子被剪接所需的时间也存在差异。Ebisuya说,“因此,我们证实人类和小鼠细胞中的细胞环境确实是导致生化反应速度不同从而导致时间尺度不同的关键。”
8.Science:揭示设定胚胎发育速度的时钟
doi:10.1126/science.aba7667; doi:10.1126/science.abe0953
为什么有些物种的怀孕时间比其他物种长?在一项新的研究中,来自英国弗朗西斯-克里克研究所的研究人员找到了设定胚胎发育速度的时钟,并发现该机制基于蛋白的制造和分解方式。这些发现可以帮助我们了解不同的哺乳动物是如何进化而来的,并有助于改进再生医学的方法。相关研究结果发表在2020年9月18日的Science期刊上,论文标题为“Species-specific pace of development is associated with differences in protein stability”。
所有哺乳动物都遵循同样的步骤从胚胎成长为成年个体。这涉及到一系列相同的事件,以相同的顺序,使用类似的基因和分子信号。然而,这些步骤的进展速度在不同物种之间有很大的不同。例如,运动神经元---控制肌肉运动的神经细胞--在小鼠中需要大约三天的时间来发育,但在人类中却需要一个多星期的时间来发育。
这些研究人员发现,蛋白分解和替换速度上的差异解释了这两个物种之间的发育速度差异。蛋白在细胞中不断地制造和分解,与人类细胞相比,小鼠细胞中这种情况发生的速度快了一倍。小鼠细胞中这种更快的蛋白周转速度是运动神经元形成速度更快的原因。
9.两篇Science揭示一些重症COVID-19病例与基因突变或攻击人体的自身抗体有关
doi:10.1126/science.abd4570; doi:10.1126/science.abd4585
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。被新型冠状病毒SARS-CoV-2感染的人可能会出现从轻度到致命的症状。如今,两项新的研究表明一些威胁生命的病例可以追溯到患者免疫系统的薄弱环节。
在患有重症COVID-19的患者中,至少有3.5%的人的抗病毒防御基因存在突变。至少有10%的重症患者会产生攻击免疫系统而不是与病毒抗争的“自身抗体”。这些发现确定了危及生命的COVID-19的某些根本原因。相关研究结果以两篇论文的形式于2020年9月24日在线发表在Science期刊上,论文标题分别为“Inborn errors of type I IFN immunity in patients with life-threatening COVID-19”和“Auto-antibodies against type I IFNs in patients with life-threatening COVID-19”。
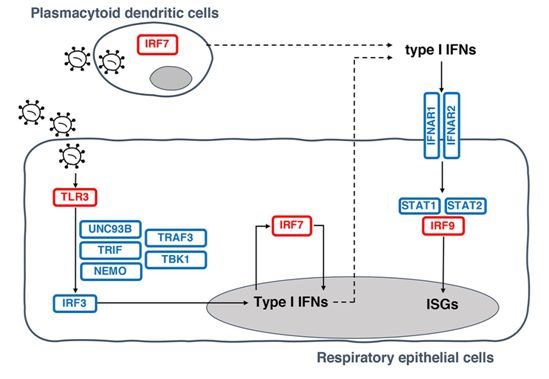
这两篇论文的通讯作者、美国洛克菲勒大学研究员Jean-Laurent Casanova说,在这么多患者中(987名患者中的101人)观察到这些有害抗体是“令人吃惊的发现”。“这两篇论文首次解释了为何COVID-19在某些人中如此严重,而其他大多数被同一病毒感染的人则不会如此。”
10.Science:发现保守的再生反应性增强子竟影响脊椎动物的再生能力
doi:10.1126/science.aaz3090
在一项新的研究中,来自美国斯托瓦斯医学研究所、霍华德-休斯医学研究所和斯坦福大学的研究人员发现保守的与两种鱼类的尾部再生有关的再生反应性增强子(regeneration-responsive enhancer)。相关研究结果近期发表在Science期刊上,论文标题为“Changes in regeneration-responsive enhancers shape regenerative capacities in vertebrates”。在这篇论文中,他们描述了他们对两种鱼类的遗传研究,以及他们了解到的保守的再生反应性增强子在让鱼类再生尾巴部分中发挥的作用。
正如这些研究人员所指出的那样,一些物种能够再生失去的身体部分。例如,蜥蜴可以重新长出失去的尾巴,而许多其他动物,包括大多数哺乳动物,则不能再生出受损的身体部位。尽管进行了大量研究,但科学家们一直无法解释这一点。在这项新的研究中,他们发现了他们认为的一个重要线索---保守的再生反应性增强子。
在研究这两种鱼类物种的DNA时,这些研究人员能够分离出一种增强子,他们将其命名为再生反应性增强子,它可影响一种叫做抑制素βA(inhibin beta A)的基因的活性,这表明它可能在允许或阻止再生方面发挥作用。他们还在开罗棘鼠(Cairo spiny mice)中发现了同样的增强子,它们能够再生耳部组织,但在家鼠中却没有发现这样的增强子,这是因为家鼠不能再生耳部。(生物谷 Bioon.com)
1.Science:深入分析人体对新冠病毒的抗体反应,为开发新的更有效疫苗奠定基础
doi:10.1126/science.abd4250
一种旨在从一滴血中检测病毒感染史的工具在COVID-19时代得到了升级。VirScan是一种可以确定1000多种不同病毒中哪些病毒感染过人的技术,如今还可以检测出包括SARS-CoV-2在内的冠状病毒的感染证据。在一项新的研究中,来自美国布莱根妇女医院和哈佛医学院的研究人员提供了大量关于人类对SARS-CoV-2的抗体反应的细节,以及这种反应在感染了更严重的COVID-19的个体中可能有什么不同。相关研究结果于2020年9月29日在线发表在Science期刊上,论文标题为“Viral epitope profiling of COVID-19 patients reveals cross-reactivity and correlates of severity”。

VirScan检测COVID-19患者血清中对SARS-CoV-2的体液反应。图片来自Science, 2020, doi:10.1126/science.abd4250。
在分析中,Elledge及其同事们通过使用VirScan分析了232名COVID-19患者和190名对照者在COVID-19出现前的血液样本,深入研究了对SARS CoV-2的抗体反应。他们确定了免疫系统可以识别的800个称为表位(epitope)的病毒位点。并非所有的表位都是一样的,有些表位可能被中和抗体识别,从而引起消除感染的反应。然而,如果身体产生了针对其他表位的抗体,它可能会启动一个不太有效的反应,从而让这种病毒占据优势。在某些情况下,包括SARS-CoV病毒在内的病毒甚至能够从身体的抗体反应中获益,利用抗体进入细胞,这种现象被称为抗体依赖性增强作用(antibody-dependent enhancement)。
就SARS-CoV-2而言,Elledge团队检测到了一系列针对不同表位的抗体频率。许多表位是公共表位(public epitope)---被大量患者的免疫系统识别的区域。其中的一个公共表位被79%的COVID-19患者识别。其他的表位被认为是私有的,只被少数人甚至一个人的免疫系统识别。10个表位存在于这种病毒进入宿主细胞所必需的关键区域,可能被中和抗体识别。该团队利用最具鉴别力的表位开发了一种快速诊断测试方法。
2.Science:重大进展!揭示内质网P5A-ATPase是一种跨膜螺旋脱位酶
doi:10.1126/science.abc5809
在一项新的研究中,作为一种研究膜蛋白定位的模型,来自美国哈佛医学院和加州大学伯克利分校的研究人员着重关注尾锚定蛋白(tail–anchored protein),尾锚定蛋白含有的单个C端跨膜区对细胞器定位是必要的,并且在很大程度上是充分的。他们推断,介导线粒体尾锚定蛋白定位的因子会直接与新生蛋白相互作用。
这些作者使用了一种无偏见的、位点特异性的交联和质谱方法来鉴定这样的蛋白跨膜区。这种方法揭示了内质网驻留的孤儿P型泵P5A-ATP酶(酵母中的Spf1;人类中的ATP13A1)直接与线粒体尾锚定蛋白相互作用。
由于遗传学研究已经将P5A-ATP酶(P5A-ATPase)与线粒体尾锚定蛋白错位联系起来,这些作者结合生化和结构方法来确定P5A-ATP酶的功能和机制。相关研究结果发表在2020年9月25日的Science期刊上,论文标题为“The endoplasmic reticulum P5A-ATPase is a transmembrane helix dislocase”。
这些作者将P5A-ATP酶的功能确定为内质网膜上跨膜区的脱位酶(dislocase)。这种功能分配表明P型ATP酶除了转运离子和脂质之外,还转运底物。P5A-ATP酶积极地将错误插入的蛋白从内质网中移出,也代表了一种以前未知的细胞保障和质量控制机制,有助于维持内质网和线粒体稳态,这也可能解释了与P5A-ATP酶功能障碍相关的多效表型。
3.两篇Science论文揭示曼氏血吸虫的弱点,有助开发治疗血吸虫病的新药物
doi:10.1126/science.abb7709; doi:10.1126/science.abb7699; doi:10.1126/science.abe0710
在来自美国德克萨斯大学西南医学中心的研究人员的领导下,两项新的研究阐明了血吸虫---引起鲜为人知的热带疾病血吸虫病的寄生性扁虫---的生物学特性和潜在的弱点。这一发现可能会改变这种每年导致高达25万人死亡的疾病的进程。相关研究结果发表在2020年9月25日的Science期刊上,论文标题分别为“A single-cell RNA-seq atlas of Schistosoma mansoni identifies a key regulator of blood feeding”和“Large-scale RNAi screening uncovers therapeutic targets in the parasite Schistosoma mansoni”。 在第一项研究中,这些研究人员深入研究了构成这种扁虫的细胞类型。虽然这种扁虫是由多种独特的组织类型组成的多细胞生物,但是人们对它的不同细胞群体知之甚少。
为了构建曼氏血吸虫(Schistosoma mansoni)---通常导致血吸虫病的血吸虫种类之一---的细胞类型图谱,Collins和他的团队使用了一种名为单细胞RNA测序的技术,该技术可以根据独特的基因表达模式区分单个细胞类型。通过这种方法,他们确定了68个分子上独特的细胞簇,包括形成肠道的干细胞群体。当这些研究人员使用一种名为RNA干扰(RNAi)的靶向方法来关闭这些细胞中一个关键基因的激活时,由此产生的血吸虫无法消化红细胞--这是它们生长的关键,也是它们引起病理的关键部分。
在第二项研究中,这些研究人员利用RNAi梳理出曼氏血吸虫中大约20%的蛋白编码基因的功能,其中曼氏血吸虫共有2216个蛋白编码基因。此前,只对这种生物中的少数基因进行了评估。
通过逐一地让这些基因失活,Collins和他的同事们发现了250多个对生存至关重要的基因。然后,这些研究人员利用药理化合物数据库,寻找有可能作用于这些基因产生的蛋白的药物,鉴定出几种对这种寄生虫有活性的化合物。他们还发现了两种蛋白激酶---一组以能够被药物靶向而闻名的蛋白---TAO和STK25对肌肉功能至关重要。当这两种激酶遭受抑制后,这种寄生虫变得瘫痪并最终死亡,这表明靶向这两种激酶的药物最终有可能治疗血吸虫病患者。下一步的研究将是寻找这些蛋白的抑制剂。
4.Science:揭示哺乳动物线粒体复合物I的作用机制
doi:10.1126/science.abc4209
线粒体是我们细胞的能量工厂,它产生的能量支撑着生命。一种称为复合物I(complex I)的巨型分子质子泵至关重要:它启动了一连串的反应,构建出质子梯度来驱动ATP产生。尽管复合物I发挥着核心作用,但是它跨膜运输质子的机制至今仍不为人所知。
如今,在一项新的研究中,奥地利科学技术研究所的Leonid Sazanov及其研究团队破解了复合物I的工作原理之谜:它的构型变化与静电波相结合,将质子移入线粒体基质中。相关研究结果于2020年9月24日在线发表在Science期刊上,论文标题为“The coupling mechanism of mammalian respiratory complex I”。

膜上的复合物I,水分子显示为红色球体,醌用黑色表示,NADH用灰色表示。图片来自IST Austria。
复合物I是呼吸链中的第一个酶。呼吸链由线粒体内膜中的一系列蛋白复合物组成,负责细胞的大部分能量生产。在呼吸链中,三种膜蛋白建立了质子梯度,将质子从细胞质中移入线粒体基质。驱动这个过程的能量主要来自于NADH分子(来源于我们吃的食物)和我们呼吸的氧气之间的电子转移。ATP合酶是呼吸链中的最后一个蛋白,利用这种质子梯度产生ATP。
5.Science:超强效抗体混合物阻断新冠病毒附着宿主细胞
doi:10.1126/science.abe3354
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,来自美国、法国、比利时和意大利的研究人员发现来自康复的COVID-19患者的超强效抗体(ultrapotent antibody)混合物可识别和封锁这种大流行冠状病毒的感染复合体(infection machinery),并阻止它进入细胞。每种类型的超强效抗体发挥的作用存在重叠,但是也略有不同。低剂量的这些超强效抗体,不管是单独使用还是混合在一起使用,都可以阻止SARS-CoV-2在肺部中复制,因而保护仓鼠在暴露于这种病毒时免受感染。相关研究结果于2020年9月24日在线发表在Science期刊上,论文标题为“Ultrapotent human antibodies protect against SARS-CoV-2 challenge via multiple mechanisms”。
这种抗体混合物的一个优点是,它们也可能防止在这次大流行期间这种冠状病毒出现的自然突变体形式逃避治疗。由于在这次冠状病毒大流行期间已在它的感染复合体中发现了一些突变体,使用抗体混合物可以中和一系列这样的病毒突变体。
6.Science:揭示HDAC6介导NLRP3和pyrin炎性体激活机制
doi:10.1126/science.aas8995
典型炎性体是一种多组分蛋白复合物,通过活化caspase-1,在对感染和危险的免疫监控中发挥关键作用。活化的caspase-1裂解白细胞介素1(IL-1)和成孔蛋白gasdermin D,从而导致细胞因子成熟和细胞焦亡。核苷酸结合结构域、富含亮氨酸的重复序列和含热蛋白(pyrin)结构域的蛋白3(NLRP3)可被尼日利亚菌素nigericin)、细胞外ATP和尿酸单钠(MSU)晶体、明矾、二氧化硅和淀粉样蛋白等各种微粒激活,而pyrin炎性体可被艰难梭菌毒素B的Rho-葡糖基化活性所刺激。炎性体激活的一个重要特征是每个细胞形成单个超分子点状物(也称为斑点)。然而,这类点状物的位置和转运仍然是未知的。
在一项新的研究中,为了破解巨噬细胞中炎性体组装和激活的部位和分子机制,来自美国哈佛医学院、波士顿儿童医院、密歇根大学、马萨诸塞大学、中国中南大学、挪威科技大学和德国波恩大学的研究人员通过细胞成像,辅以细胞和小鼠中的药物抑制和靶向剔除,可视化观察炎性体组装。相关研究结果发表在2020年9月18日的Science期刊上,论文标题为“HDAC6 mediates an aggresome-like mechanism for NLRP3 and pyrin inflammasome activation”。
这项研究揭示了HDAC6依赖性的NLRP3和pyrin炎性体组装与MTOC中的聚集体(aggresome)形成之间存在着意想不到的平行关系,所形成的聚集体可用于泛素化病理聚集物的自噬降解。NLRP3和pyrin炎性体的MTOC定位所发挥的双重激活和抑制作用可能是实现炎性体平衡调节的关键。
7.Science:不同的生化反应速度导致物种特异性的分节时钟周期
doi:10.1126/science.aba7668; doi:10.1126/science.abe0953
在一项新的研究中,来自日本理化学研究所、京都大学、西班牙欧洲分子生物学实验室和庞培法布拉大学的研究人员发现“分节时钟(segmentation clock)”---一个控制胚胎体型形成的基因网络---在人类中的进展速度比在小鼠中更慢,原因在于人类细胞中的生化反应更慢。生化反应速度的差异可能是物种间发育节奏差异的基础。相关研究结果发表在2020年9月18日的Science期刊上,论文标题为“Species-specific segmentation clock periods are due to differential biochemical reaction speeds”。

图片来自CC0 Public Domain。
在脊椎动物发育的早期阶段,胚胎发育成一系列的“分节(segment)”,最终分化成不同类型的组织,比如肌肉或肋骨。众所周知,这个过程是由一个振荡的生化过程(即所谓的分节时钟)控制的,分节时钟在不同的物种之间是不同的。例如,小鼠的分节时钟约为2小时,人类约为5小时。然而,为什么这个分节时钟周期的长度在不同物种之间会有所不同,一直是个谜。
他们研究了HES7蛋白的降解率等因素是否存在差异,毕竟HES7蛋白是分节时钟周期中的一个重要因素。他们观察了包括小鼠和人类蛋白降解速度在内的一系列过程,证实了这一假设:两种蛋白在人类细胞中的降解速度都比小鼠细胞慢。此外,HES7转录和翻译成蛋白所需的时间,以及HES7内含子被剪接所需的时间也存在差异。Ebisuya说,“因此,我们证实人类和小鼠细胞中的细胞环境确实是导致生化反应速度不同从而导致时间尺度不同的关键。”
8.Science:揭示设定胚胎发育速度的时钟
doi:10.1126/science.aba7667; doi:10.1126/science.abe0953
为什么有些物种的怀孕时间比其他物种长?在一项新的研究中,来自英国弗朗西斯-克里克研究所的研究人员找到了设定胚胎发育速度的时钟,并发现该机制基于蛋白的制造和分解方式。这些发现可以帮助我们了解不同的哺乳动物是如何进化而来的,并有助于改进再生医学的方法。相关研究结果发表在2020年9月18日的Science期刊上,论文标题为“Species-specific pace of development is associated with differences in protein stability”。
所有哺乳动物都遵循同样的步骤从胚胎成长为成年个体。这涉及到一系列相同的事件,以相同的顺序,使用类似的基因和分子信号。然而,这些步骤的进展速度在不同物种之间有很大的不同。例如,运动神经元---控制肌肉运动的神经细胞--在小鼠中需要大约三天的时间来发育,但在人类中却需要一个多星期的时间来发育。
这些研究人员发现,蛋白分解和替换速度上的差异解释了这两个物种之间的发育速度差异。蛋白在细胞中不断地制造和分解,与人类细胞相比,小鼠细胞中这种情况发生的速度快了一倍。小鼠细胞中这种更快的蛋白周转速度是运动神经元形成速度更快的原因。
9.两篇Science揭示一些重症COVID-19病例与基因突变或攻击人体的自身抗体有关
doi:10.1126/science.abd4570; doi:10.1126/science.abd4585
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。被新型冠状病毒SARS-CoV-2感染的人可能会出现从轻度到致命的症状。如今,两项新的研究表明一些威胁生命的病例可以追溯到患者免疫系统的薄弱环节。
在患有重症COVID-19的患者中,至少有3.5%的人的抗病毒防御基因存在突变。至少有10%的重症患者会产生攻击免疫系统而不是与病毒抗争的“自身抗体”。这些发现确定了危及生命的COVID-19的某些根本原因。相关研究结果以两篇论文的形式于2020年9月24日在线发表在Science期刊上,论文标题分别为“Inborn errors of type I IFN immunity in patients with life-threatening COVID-19”和“Auto-antibodies against type I IFNs in patients with life-threatening COVID-19”。

图片来自Science, 2020, doi:10.1126/science.abd4570。
这两篇论文的通讯作者、美国洛克菲勒大学研究员Jean-Laurent Casanova说,在这么多患者中(987名患者中的101人)观察到这些有害抗体是“令人吃惊的发现”。“这两篇论文首次解释了为何COVID-19在某些人中如此严重,而其他大多数被同一病毒感染的人则不会如此。”
10.Science:发现保守的再生反应性增强子竟影响脊椎动物的再生能力
doi:10.1126/science.aaz3090
在一项新的研究中,来自美国斯托瓦斯医学研究所、霍华德-休斯医学研究所和斯坦福大学的研究人员发现保守的与两种鱼类的尾部再生有关的再生反应性增强子(regeneration-responsive enhancer)。相关研究结果近期发表在Science期刊上,论文标题为“Changes in regeneration-responsive enhancers shape regenerative capacities in vertebrates”。在这篇论文中,他们描述了他们对两种鱼类的遗传研究,以及他们了解到的保守的再生反应性增强子在让鱼类再生尾巴部分中发挥的作用。
正如这些研究人员所指出的那样,一些物种能够再生失去的身体部分。例如,蜥蜴可以重新长出失去的尾巴,而许多其他动物,包括大多数哺乳动物,则不能再生出受损的身体部位。尽管进行了大量研究,但科学家们一直无法解释这一点。在这项新的研究中,他们发现了他们认为的一个重要线索---保守的再生反应性增强子。
在研究这两种鱼类物种的DNA时,这些研究人员能够分离出一种增强子,他们将其命名为再生反应性增强子,它可影响一种叫做抑制素βA(inhibin beta A)的基因的活性,这表明它可能在允许或阻止再生方面发挥作用。他们还在开罗棘鼠(Cairo spiny mice)中发现了同样的增强子,它们能够再生耳部组织,但在家鼠中却没有发现这样的增强子,这是因为家鼠不能再生耳部。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


