照亮百年漫漫长夜!首创新药改写梗阻性肥厚型心肌病治疗范式
来源:奇点网 2025-05-22 12:45
玛伐凯泰是全球首个且目前唯一一个获批上市的心肌肌球蛋白抑制剂,直接针梗阻性HCM的核心病理生理机制,显著改善了LVOT压差和患者NYHA分级,大大提高患者生活质量。
今年4月初,浙大二院发布的一条消息迅速登上各大平台的热搜榜。
浙大二院成功完成了亚洲首例家族性肥厚型心肌病合并肝功能衰竭患者的心肝同期联合移植手术,且患者康复出院!
与此同时,年轻人猝死的“隐形杀手”——肥厚型心肌病(HCM),也因此再次成为公众关注的焦点。有统计数据显示,HCM是35岁以下年轻人心源性猝死的最大幕后黑手[1]。据估算,在中国人群中,每10万人中大约有80人患有HCM[2]。
在HCM自1868年首次被描述之后的150多年里,由于没有认清它的发病机制,仅能对症治疗;手术治疗难度大、风险高,术后并发症风险也很高。因此,HCM患者亟需新的有效治疗方案。玛伐凯泰的诞生,让HCM患者首次看到了希望。
丨首创机制!HCM领域迎来“划时代”的首创新药
在人类医学发展的长河中,总有一些药物不仅是“新的”,更是改变治疗格局的“划时代”创新。
2001年,靶向药伊马替尼获批上市,将慢性髓系白血病患者的5年生存率从30%提高到近90%,正式揭开了癌症精准治疗时代的序幕。此后,全球有逾100款蛋白激酶抑制剂相继问世,彻底改写了癌症及多种炎症性疾病的治疗范式。
2014年,PD-1抑制剂纳武利尤单抗等的获批,首次真正松开了肿瘤对人体免疫系统踩下的刹车,开启了癌症免疫治疗的新纪元。如今,全球范围内已经有20多款免疫检查点抑制剂获批上市,在各种癌症的地盘攻城略地,让无数原本无药可医的患者重获新生。
无论是伊马替尼,还是纳武利尤单抗,它们都打破了传统治疗路径,首次锚定全新靶点或机制,实现了从“对症治疗”到“对因干预”的根本性转变。这,就是首创(First-in-class)新药的核心价值所在。对于梗阻性HCM患者而言,玛伐凯泰就是这样一款首创新药。它首次直击梗阻性HCM的核心病理机制,以雷霆之势撕开梗阻性HCM的铁幕。
人类对HCM的认知过程非常曲折。由于HCM异质性强,自1868年首次有文献报道以来后的一个多世纪里[3],科学家对HCM都缺乏统一认知。直到1989年,美国科学家宣布找到了导致HCM的突变基因——编码β-肌球蛋白重链的MYH7[5,6]。自此开始,HCM被认为是一种遗传病。
二十五年之后,斯坦福大学James Spudich在HCM的发病机制上取得重要突破,他认为发生在β-肌球蛋白上的突变,会将处于“关闭”状态的β-肌球蛋白转变成“开放”状态,增加了有结合能力的β-肌球蛋白,从而提升了心肌的动力输出,进而导致HCM的发生[7]。
更重要的是,几乎在同一时间,Spudich等人还筛选到了抑制β-肌球蛋白ATP酶活性的理想小分子选择性变构抑制剂MYK-461,也就是现在为我们所熟知的玛伐凯泰,它能与β-肌球蛋白可逆性结合[8]。两年半之后,Spudich等人进一步证实,玛伐凯泰确实能将β-肌球蛋白头部稳定在关闭的状态[9]。简单来说,玛伐凯泰可以减少肌球蛋白-肌动蛋白横桥连接的形成,进而避免心肌的过度收缩。
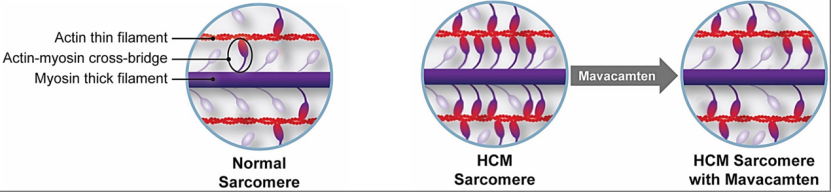
▲ 玛伐凯泰作用机制
2023年的10月,玛伐凯泰因其创新的机制在美国摘得医药和生物医疗行业的最高荣誉——享有医疗界“诺贝尔奖”之称的盖伦奖“最佳生物技术产品奖”[10]。值得一提的是,揭开癌症精准治疗时代序幕的伊马替尼在2009年获得盖伦奖“最佳药品奖”;而开启癌症免疫治疗新纪元的纳武利尤单抗等PD-1抑制剂,也在2015年获得盖伦奖“最佳生物技术产品奖”。
时至今日,越来越多的心肌肌球蛋白抑制剂处于研发之中。
丨首创疗法!HCM的治疗范式迎来突破
真正意义上的首创新药,不仅在作用机制上开辟新天地,还会直击临床问题的核心“痛点”,为长期未解的临床难题提供真正的解决方案。
在玛伐凯泰诞生之前,β受体阻滞剂等药物,虽然能在一定程度上改善患者的症状,但是无法针对病理生理机制,对患者的生活质量改善非常有限。手术虽然也可以改善HCM症状,但手术难度大、并发症风险高,患者接受度低。显然,HCM患者仍缺乏有效的治疗药物,临床存在极大未满足需求。
在HCM首次被报道的整整150年之后,HCM终于迎来了历史性时刻。2018年5月,首创新药玛伐凯泰的关键多中心、国际性、双盲3期临床研究EXPLORER-HCM正式启动。两年之后,研究结果刊登在顶级医学期刊《柳叶刀》上,结果显示,玛伐凯泰治疗组达到主要终点的患者占比,是对照组的2倍多(37% vs 17%)[11]。总的来说,与安慰剂相比,玛伐凯泰可显著改善梗阻性HCM患者的运动能力、左心室流出道(LVOT)梗阻、NYHA功能分级和健康状况。
一年之后,玛伐凯泰对梗阻性HCM患者健康状况的影响数据也在《柳叶刀》发布[12]。结果显示,与安慰剂对比,玛伐凯泰显著改善了有症状梗阻性HCM患者的健康状况。具体来看,在症状、生理功能限制、社会功能限制、生活质量等各个方面,玛伐凯泰治疗组患者的评分改善均显著优于安慰剂组,提示玛伐凯泰对健康状态的改善是多方面的。
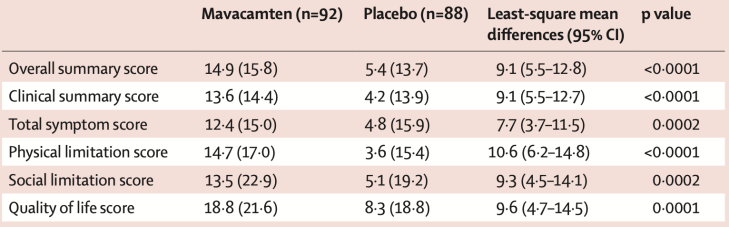
▲ 玛伐凯泰对健康状态的改善是多方面的
此外,在多中心、随机、双盲、安慰剂对照3期临床研究VALOR-HCM中,研究人员还发现,玛伐凯泰可以显著降低药物难治性、症状性梗阻性HCM患者的侵入性室间隔减容术干预需求:接受玛伐凯泰治疗的患者中,仅17.9%仍需考虑室间隔减容术治疗,而安慰剂组这一比例高达76.8%[13]。这说明首创新药玛伐凯泰可以成为改变治疗路径、减少侵入性手段的重要武器。
由于HCM是一种慢性、进行性心脏疾病,随着患病时间的延长,疾病会加重。因此,疗效持久的长期治疗对缓解患者临床症状、提高患者生活质量非常重要。作为一种首创新药,玛伐凯泰的长期疗效和安全性更值得关注。2024年发布的长达3.5年的随访数据显示,玛伐凯泰持续改善梗阻性肥厚型心肌病患者心脏功能和症状;且长期安全性与已知的安全性特征一致,未发现新的安全性信号[14]。

▲ 玛伐凯泰的长期治疗效果[14]
这些高质量和长期随访的临床研究数据,不仅是支撑玛伐凯泰疗效的科学证据,更是玛伐凯泰对HCM治疗困局的一次系统性回应。因为,它不再是“治标”的“止疼药”,而是首次给出了HCM的“对因”治疗选择。
丨首创风范!为中国患者量身定制更优方案
在全球多中心临床试验中取得阳性结果,只是首创新药迈向成功的第一步,能否服务于特定地区/种族的患者群体,决定了它成功的高度。而这,就需要通过本土临床研究来验证。
EXPLORER-CN是首个也是目前唯一一个专为中国有症状梗阻性HCM患者设计的随机、双盲、安慰剂对照临床试验,由中国研究者主导,覆盖中国12家临床中心,具有高度代表性[15]。
值得一提的是,在设计临床试验时,研究人员充分考虑了中国的临床实践和患者的药物代谢差异问题,在全球EXPLORER-HCM研究基础上,中国研究人员给EXPLORER-CN研究做了两个改良和优化。首先,从中国临床实践和可行性方面考虑,研究主要终点选择了Valsalva动作激发的LVOT峰值压差;其次,作为首创新药,玛伐凯泰此前没有在中国梗阻性HCM患者群体中使用过,考虑到中国人群平均体重较低且CYP2C19慢代谢比例较高,研究人员将EXPLORER-CN研究的起始用药剂量定为较低的2.5mg/天,而不是EXPLORER-HCM的5mg/天。
从研究结果来看,与安慰剂相比,玛伐凯泰治疗30周显著改善了患者的Valsalva LVOT峰值压差,而且这种改善从治疗开始后的第一次随访,即第4周就可以观察到,并且在治疗期间持续改善。亚组分析结果显示,玛伐凯泰治疗在各亚组中均显示出一致的获益,包括性别、年龄、基线NYHA分级、CYP2C19代谢型,以及是否合并使用β受体阻滞剂等。此外,在安全性方面,玛伐凯泰组和安慰剂组治疗期间不良事件发生率相似,没有发现新的安全性信号。
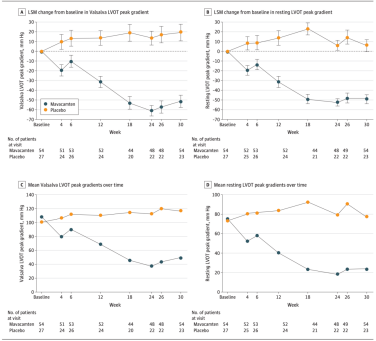
▲ 玛伐凯泰治疗中国梗阻性HCM患者的效果[15](Valsalva LVOT压差和静息LVOT压差)
在对58例有心脏磁共振(CMR)合格影像数据的患者进行分析时,研究人员还发现,与安慰剂组相比,玛伐凯泰治疗组从基线到第30周左心室质量指数降低,最大左心室壁厚度变薄,左心房容积指数降低,这些结果说明玛伐凯泰具有良好的心脏重构作用,能改善患者心脏结构和舒张功能。
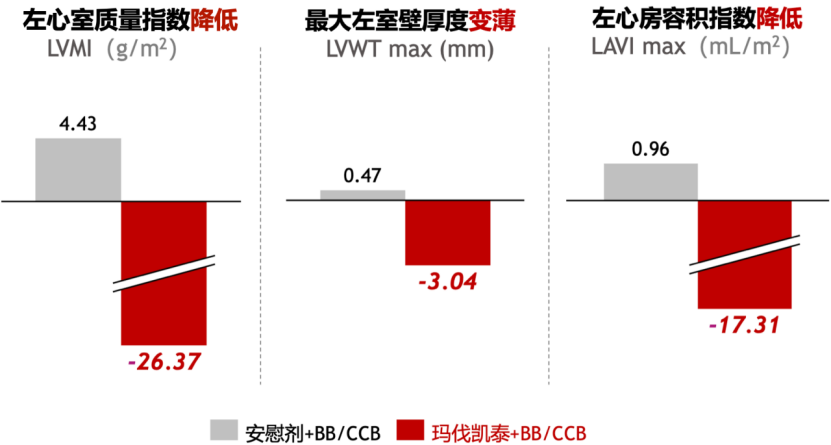
玛伐凯泰改善患者心脏结构和舒张功能[15]
EXPLORER-CN和EXPLORER-HCM研究共同表明,玛伐凯泰在包括中国梗阻性HCM患者群体在内的不同人群中,均有显著的疗效和良好的耐受性。不难看出,EXPLORER-CN研究是对首创新药玛伐凯泰的疗效与安全性的又一次验证。尤其值得注意的是,EXPLORER-CN研究虽然使用了较低起始剂量的玛伐凯泰,但是并未影响玛伐凯泰的疗效。
值得一提的是,玛伐凯泰在获得中国国家药品监督管理局(NMPA)批准之前,就获得了《中国肥厚型心肌病指南2022》[16]、《中国成人肥厚型心肌病诊断与治疗指南2023》[17]和《国家心力衰竭指南2023》[18]的介绍或推荐,用于梗阻性HCM患者的治疗。
对于中国梗阻性HCM患者而言,还有个好消息是,在2024年底,玛伐凯泰就被纳入国家医保目录,今年1月医保目录正式落地执行。这也意味着,我国梗阻性HCM患者终于有了可用且可负担的首创新药。
丨开创未来
总的来说,作为梗阻性HCM的“首创机制”新药,玛伐凯泰是全球首个且目前唯一一个获批上市的心肌肌球蛋白抑制剂,它直接针对梗阻性HCM的核心病理生理机制,显著改善了LVOT压差和患者NYHA分级,也改善了患者的运动能力和生活质量。
值得强调的是,截至目前为止,已经有大量优质临床试验和长期随访试验,以及中国人群的高质量临床试验,验证了玛伐凯泰的疗效。以上这些证据表明,梗阻性HCM迎来了首个缓解临床症状、改善心脏功能和结构,且有望延缓疾病进展的创新药物。
玛伐凯泰的故事,不仅是梗阻性HCM首创新药走向临床的过程,更是一个从“原理验证”到“改变治疗范式”的首创新药范本。
参考文献:
[1].Frey N, Luedde M, Katus HA. Mechanisms of disease: hypertrophic cardiomyopathy. Nat Rev Cardiol. 2011;9(2):91-100. doi:10.1038/nrcardio.2011.159
[2].Zou Y, Song L, Wang Z, et al. Prevalence of idiopathic hypertrophic cardiomyopathy in China: a population-based echocardiographic analysis of 8080 adults. Am J Med. 2004;116(1):14-18. doi:10.1016/j.amjmed.2003.05.009
[3].Liew AC, Vassiliou VS, Cooper R, Raphael CE. Hypertrophic Cardiomyopathy-Past, Present and Future. J Clin Med. 2017;6(12):118. doi:10.3390/jcm6120118
[5].Jarcho JA, McKenna W, Pare JA, et al. Mapping a gene for familial hypertrophic cardiomyopathy to chromosome 14q1. N Engl J Med. 1989;321(20):1372-1378. doi:10.1056/NEJM198911163212005
[6].Geisterfer-Lowrance AA, Kass S, Tanigawa G, et al. A molecular basis for familial hypertrophic cardiomyopathy: a beta cardiac myosin heavy chain gene missense mutation. Cell. 1990;62(5):999-1006. doi:10.1016/0092-8674(90)90274-i
[7].Spudich JA. The myosin mesa and a possible unifying hypothesis for the molecular basis of human hypertrophic cardiomyopathy. Biochem Soc Trans. 2015;43(1):64-72. doi:10.1042/BST20140324
[8].Green EM, Wakimoto H, Anderson RL, et al. A small-molecule inhibitor of sarcomere contractility suppresses hypertrophic cardiomyopathy in mice. Science. 2016;351(6273):617-621. doi:10.1126/science.aad3456
[9].Anderson RL, Trivedi DV, Sarkar SS, et al. Deciphering the super relaxed state of human β-cardiac myosin and the mode of action of mavacamten from myosin molecules to muscle fibers. Proc Natl Acad Sci U S A. 2018;115(35):E8143-E8152. doi:10.1073/pnas.1809540115
[10].https://www.galienfoundation.org/prix-galien-usa
[11].Olivotto I, Oreziak A, Barriales-Villa R, et al. Mavacamten for treatment of symptomatic obstructive hypertrophic cardiomyopathy (EXPLORER-HCM): a randomised, double-blind, placebo-controlled, phase 3 trial [published correction appears in Lancet. 2020 Sep 12;396(10253):758. doi: 10.1016/S0140-6736(20)31872-9.]. Lancet. 2020;396(10253):759-769. doi:10.1016/S0140-6736(20)31792-X
[12].Spertus JA, Fine JT, Elliott P, et al. Mavacamten for treatment of symptomatic obstructive hypertrophic cardiomyopathy (EXPLORER-HCM): health status analysis of a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2021;397(10293):2467-2475. doi:10.1016/S0140-6736(21)00763-7
[13].Desai MY, Owens A, Geske JB, et al. Myosin Inhibition in Patients With Obstructive Hypertrophic Cardiomyopathy Referred for Septal Reduction Therapy. J Am Coll Cardiol. 2022;80(2):95-108. doi:10.1016/j.jacc.2022.04.048
[14].Garcia-Pavia P, Oręziak A, Masri A, et al. Long-term effect of mavacamten in obstructive hypertrophic cardiomyopathy. Eur Heart J. 2024;45(47):5071-5083. doi:10.1093/eurheartj/ehae579
[15].Tian Z, Li L, Li X, et al. Effect of Mavacamten on Chinese Patients With Symptomatic Obstructive Hypertrophic Cardiomyopathy: The EXPLORER-CN Randomized Clinical Trial. JAMA Cardiol. 2023;8(10):957-965. doi:10.1001/jamacardio.2023.3030
[16].国家心血管病专家委员会心力衰竭专业委员会, 中国医师协会心力衰竭专业委员会, 中华医学会心血管分会心力衰竭学组, 等 . 中国肥厚型心肌病指南2022[J]. 中华心力衰竭和心肌病杂志, 2022, 6(2): 80-105. DOI: 10.3760/cma.j.cn1101460-20220805-00070.
[17].国家心血管病中心心肌病专科联盟、中国医疗保健国际交流促进会心血管病精准医学分会“中国成人肥厚型心肌病诊断与治疗指南2023”专家组,宋雷,邹玉宝,等.中国成人肥厚型心肌病诊断与治疗指南2023[J].中国分子心脏病学杂志, 2023, 23(1):35.
[18].国家心血管病中心,国家心血管病专家委员会心力衰竭专业委员会,中国医师协会心力衰竭专业委员会,等. 国家心力衰竭指南2023[J]. 中华心力衰竭和心肌病杂志,2023,07(04):215-311. DOI:10.3760/cma.j.issn.101460-20231209-00052
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


