获批关键II期临床,君赛 GC101 TIL 疗法更安全、更优效
来源:网络 2024-12-05 17:00
近日,君赛生物宣布,GC101 TIL注射液首个关键性II期注册临床试验已获得国家药品监督管理局药品审评中心(CDE)批准,用于经PD-1抗体治疗进展或不耐受的晚期黑色素瘤患者(NCT06703398)。
该试验将由全球黑色素瘤领域的权威专家、北京大学肿瘤医院郭军教授担任主要研究者,在全国范围开展多中心临床研究。
GC101是全球首款无需清淋、无需IL-2注射的天然TIL细胞疗法,其首个适应症获准进入关键II期临床,是实体瘤细胞治疗领域的一大重要突破。在中国,黑色素瘤的死亡率较高,且发病率呈现逐年上升的趋势。与欧美白种人相比,我国黑色素瘤的特点存在显著差异:在白种人中,约90%的黑色素瘤原发于皮肤;而在亚洲人和其他有色人种中,约50%的黑色素瘤原发于肢端,20-30%原发于黏膜。相比之下,肢端和黏膜型的黑色素瘤预后更差。
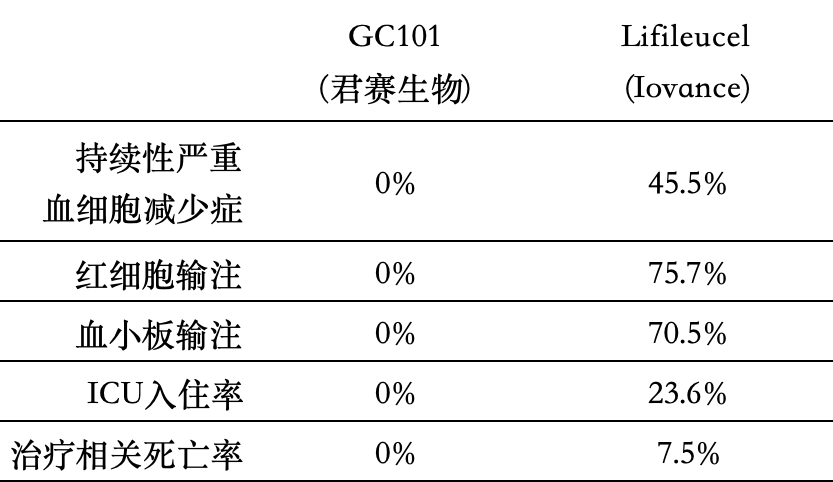
2024年2月,美国FDA加速批准了首个TIL疗法Lifileucel,用于治疗二线及以上的晚期黑色素瘤患者,其客观响应率(ORR)达到31.5%,中位无进展生存期(mPFS)为4.1个月。然而,由于治疗过程中需要高强度的清淋化疗和大剂量IL-2的重复注射,引发了众多不良反应,因此FDA给予了黑框警告。
GC101是君赛生物基于自主开发的DeepTIL®细胞扩增平台研发的TIL疗法,无需高浓度IL-2和滋养细胞即可培养出足够数量的高活性TIL细胞,且不依赖于IL-2。在临床应用中,GC101无需清淋和任何剂量的IL-2注射,就能展现出卓越的疗效。尽管GC101的受试者主要是更难治疗的肢端和黏膜型黑色素瘤患者,但其ORR与Lifileucel相似,且mPFS延长了一个多月。在安全性方面,GC101的受试者在普通病房接受治疗,没有出现治疗相关的死亡和ICU入住案例,也没有患者需要接受血细胞输注,住院时间缩短了约80%。
君赛生物创始人、CEO&CTO金华君博士表示:“GC101进入关键性II期临床试验,是君赛生物在TIL创新疗法研发道路上的一个重要里程碑。衷心感谢受试者和家属的信任和配合,感谢临床研究者团队的努力和付出!我们期待通过进一步的临床研究,确立GC101良好的临床有效性,早日造福更多的黑色素瘤患者。”
关于GC101GC101依托君赛生物自主开发、全球领先的DeepTIL®细胞富集扩增平台开发而成,是君赛生物研发进度最快的TIL疗法管线,也是全球首款无需清淋、无需IL-2注射的天然TIL疗法。
已有临床数据显示,GC101针对多种类型晚期实体肿瘤的客观缓解率(ORR)超35%,已有4例患者肿瘤被完全清除,获得完全缓解(CR)疗效,其中无瘤生存最久时间已超3年。
如您想了解更多关于本临床试验的相关信息,请通过以下联系方式详细咨询。
临床邮箱:clinicaltrials@juncell.com
联系电话:021-69990503
杨老师:18019732895(同微信)
张老师:18001759113(同微信)
关于君赛生物君赛生物专注于肿瘤浸润淋巴细胞(Tumor-infiltrating Lymphocyte,TIL)创新药与创新疗法开发,自主建立国际领先的DeepTIL®细胞富集扩增与NovaGMP®基因修饰技术平台,据此开发一系列全球同类首创(First-in-class)或同类最优(Best-in-class)的天然TIL与基因修饰TIL管线,其中2款已进入临床试验阶段,正面向社会招募晚期实体肿瘤患者。
全球首款无需清淋、无需IL-2注射的天然TIL疗法GC101,以及全球首创的非病毒载体基因修饰TIL疗法GC203,在10种不同类型晚期实体肿瘤中均展现优异临床疗效(包括多线治疗失败的胰腺癌与高级别脑胶质瘤),其中7例患者肿瘤被完全清除,无瘤生存最久时间已超3年。
君赛生物将坚守“精雕细胞,守望生命”的崇高使命,胸怀“以科技创奇迹,使奇迹变平常”的美好愿景,秉承“专注、拓新、包容、共享”的核心价值观,开发更多高品质的TIL创新疗法,满足广大癌症患者的差异化需求。
更多信息请访问:www.juncell.com
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


