Cell Discov | 西湖大学谢琦等团队揭示胶质母细胞瘤干细胞的选择性聚腺苷化
来源:生物探索 2024-03-25 13:29
在这里,研究人员改进了一种更具生理学相关性的体内CRISPR筛选方法,以识别对GSC维持和肿瘤形成至关重要的泛素连接酶和去泛素化酶。
西湖大学谢琦,深圳湾实验室李磊和匹兹堡大学Jeremy N. Rich共同通讯在Cell Discovery 发表题为“RBBP6 maintains glioblastoma stem cells through CPSF3-dependent alternative polyadenylation”的研究论文。该研究进行了并行的体外和体内CRISPR/Cas9敲除筛选,针对人类泛素E3连接酶和去泛素化酶,揭示了E3连接酶RBBP6作为GSC维持的一个必需因子,靶向RBBP6抑制了GSC的增殖和肿瘤起始。
在机制上,RBBP6介导CPSF3的K63-链接泛素化,稳定了CPSF3来调节选择性多腺苷酸化事件。RBBP6敲除导致MYC竞争性内源性RNA的3'UTR缩短,从而释放了miR-590-3p从缩短的UTRs中,从而降低了MYC的表达。用小分子抑制剂(JTE-607)靶向CPSF3可以减少GSC的存活率并抑制体内肿瘤生长。总的来说,RBBP6通过调节CPSF3依赖的选择性多腺苷酸化在GSC中维持高MYC表达,为胶质母细胞瘤提供了一个潜在的治疗范例。

胶质母细胞瘤是最常见和致命的原发性脑肿瘤,中位生存时间不到两年。目前胶质母细胞瘤的标准治疗包括最大程度的手术切除,联合放疗和化疗,随后进行辅助化疗,只能提供姑息治疗。胶质母细胞瘤表现出肿瘤内异质性,其中自我更新的胶质母细胞处于层级顶端。胶质母细胞以其自我更新和肿瘤起始能力而功能特异化,此外还对肿瘤血管生成、放射抵抗力和化疗抵抗力有额外的贡献。
胶质母细胞瘤是最早进行全面遗传分析的肿瘤之一,揭示了导致信号传导失调的频繁变异,包括涉及表观遗传学变化、转录调节因子和转录后调节的变异。然而,基于遗传突变的精准医学对胶质母细胞瘤患者的临床管理影响有限,表明替代的分子靶点可能提供治疗益处。泛素化是调节底物蛋白命运和/或功能的最常见的翻译后修饰之一。泛素-蛋白酶体通路维持大多数蛋白质的稳态。泛素分子通过涉及E1(泛素激活)、E2(泛素连接)和E3(泛素连接酶)酶的催化级联添加到靶标蛋白中,可以通过去泛素化酶(DUBs)逆转。
先前的研究已将泛素途径与胶质母细胞瘤的生长总体和GSC的维持特异性联系起来。例如,胶质母细胞瘤可能过表达USP15,该酶结合SMAD7-SMAD特异性E3泛素蛋白连接酶2(SMURF2)复合物去泛素化并稳定型I转化生长因子-β受体(TβR-I),增强TGF-β信号传导。在GSCs中,USP9x取消乙醛脱氢酶1A3(ALDH1A3)的多泛素化以稳定ALDH1A3并维持GSCs。用USP9x抑制剂WP1130处理GSCs可诱导ALDH1A3降解并抑制GSC的生长。此外,USP13和FBXL14相互调节GSCs中MYC的多泛素化。因此,去泛素化酶和泛素连接酶可能是胶质母细胞瘤的潜在治疗靶点。
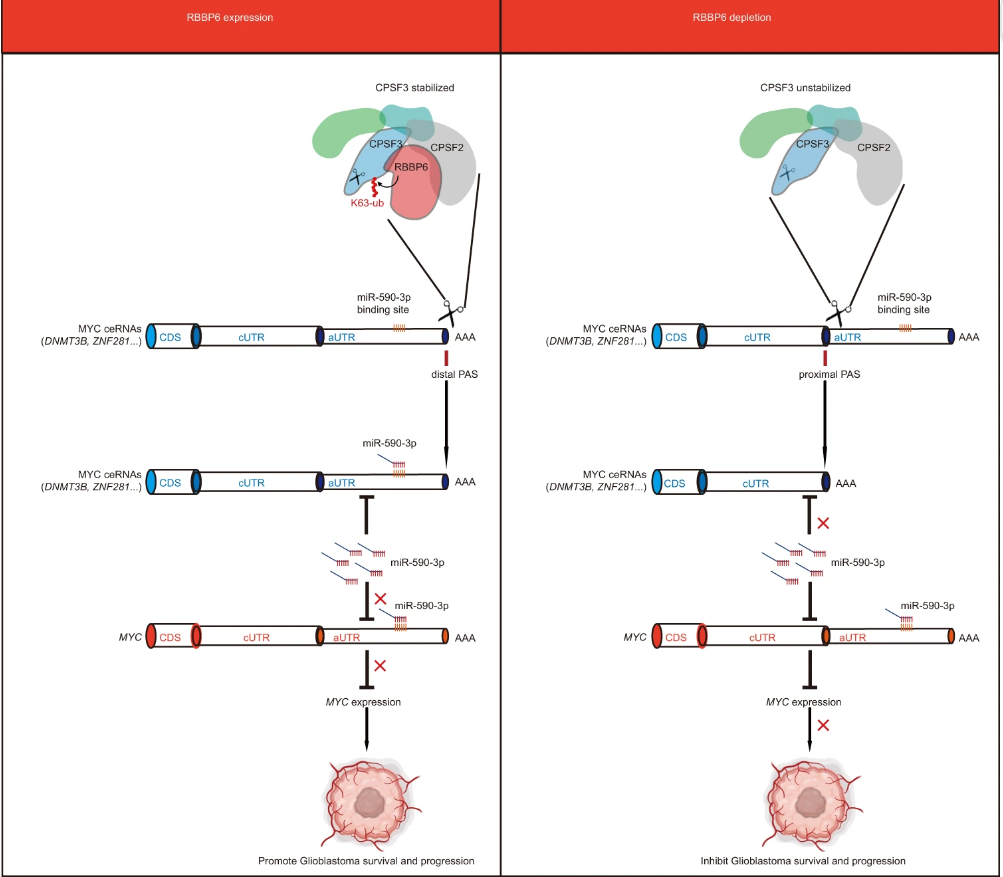
模式图(Credit: Cell Discovery)
CRISPR/Cas9基因敲除(KO)高通量筛选已被证明是癌症治疗中目标基因发现的有效平台。先前的CRISPR筛选研究主要集中在体外培养的细胞模型上,这些模型无法充分代表肿瘤微环境的复杂效应,这种方法可能限制了药物开发的成功。在这里,作者改进了一种更具生理学相关性的体内CRISPR筛选方法,以识别对GSC维持和肿瘤形成至关重要的泛素连接酶和去泛素化酶。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


