《细胞》子刊:中国医学科学院肿瘤医院团队找到与肺鳞癌免疫治疗效果有关的重要线索!
来源:奇点糕 2023-12-16 13:01
晚期非小细胞肺癌(NSCLC)免疫治疗的临床研究成果,现在可以说是车载斗量,但也不能闷着头一个劲儿地只顾做试验。对已有的试验数据展开深度分析,寻找指导精准免疫治疗的线索,同样是意义十分重要的工作。
晚期非小细胞肺癌(NSCLC)免疫治疗的临床研究成果,现在可以说是车载斗量,但也不能闷着头一个劲儿地只顾做试验。对已有的试验数据展开深度分析,寻找指导精准免疫治疗的线索,同样是意义十分重要的工作。
近日在Cell Reports Medicine期刊上,中国医学科学院肿瘤医院王洁、王志杰教授团队发表的最新研究,就基于对国产免疫治疗药物临床III期RATIONALE-307研究的分析,找到了一组可预测免疫治疗+化疗方案一线用于晚期肺鳞癌患者的基因特征(共11个基因),并发现转录因子NRF2通路激活可调控PD-L1表达水平,从而对免疫治疗有不利影响[1]。
一图总结论文核心内容
晚期肺鳞癌患者接受一线免疫治疗时,可从免疫单药或免疫+化疗两种方案中进行抉择,不过免疫单药治疗一般不用于PD-L1高表达(≥50%)患者以外的人群,而对并非PD-L1高表达的患者,以PD-L1表达或肿瘤突变负荷(TMB)来指导治疗的精准度都不理想,所以寻找指导治疗的Biomarker,特别是适用于中国患者的Biomarker,还得依托中国临床研究。
本次中国医学科学院肿瘤医院团队分析的RATIONALE-307研究主角是PD-1抑制剂替雷利珠单抗,联合紫杉醇/白蛋白结合型紫杉醇+卡铂两种化疗方案使用(1:1:1分组),研究已于2021年报告主要终点无进展生存期(PFS)的阳性结果[2],而入组的360例患者大多都保留了血样或组织样本,以检测PD-L1表达水平、组织/血液TMB(tTMB/bTMB)及基因表达水平。
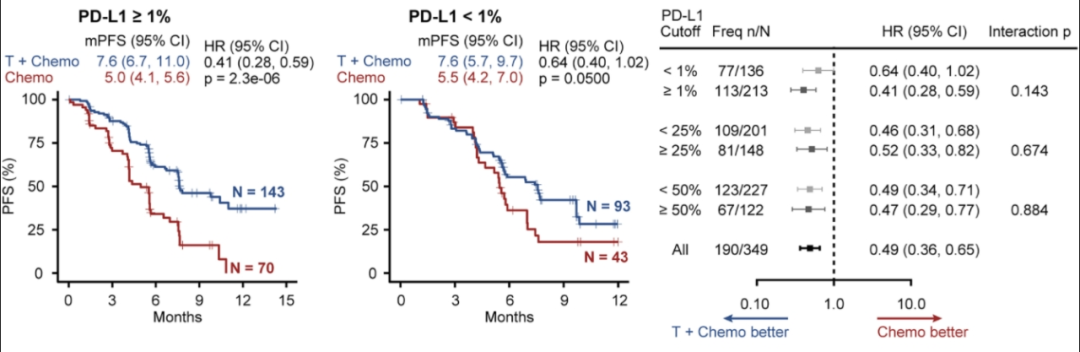
分析的第一步还是从PD-L1表达水平做起,虽然PD-L1表达阳性(≥1%,n=213)的患者相比PD-L1阴性患者,有从免疫+化疗一线治疗中获益更大的趋势(PFS HR=0.43/0.64, p=0.143),但无论是以25%还是50%作为PD-L1高表达的Cut-off值,都不能很好地提示PFS获益。
对tTMB及bTMB的分析结论也大体相似,即虽然TMB水平较高的患者有PFS获益更显著的趋势,但都不能达到统计学差异性(p均>0.05),那就只能探索其它的Biomarker了。研究团队基于对275例患者基线时肿瘤样本的基因测序结果,构建基因表达谱(GEP)来寻找与患者PFS水平显著相关的基因,并经两步筛选出11个影响免疫相关功能的基因。
这些基因调控的功能涉及干扰素信号(SP110, JAK2及STAT1)、巨噬细胞调控(ESPTI1, SLAMF8)以及T细胞功能(IL7R, CCL4, HLA.A及SELPLG)等等,主要在T细胞和髓系细胞中高表达,而高表达上述基因的患者,接受免疫+化疗一线治疗的中位PFS为7.8个月,显著优于化疗的4.2个月(HR=0.28, p<0.001);基因表达低于平均水平的患者,接受两种治疗PFS则相近。
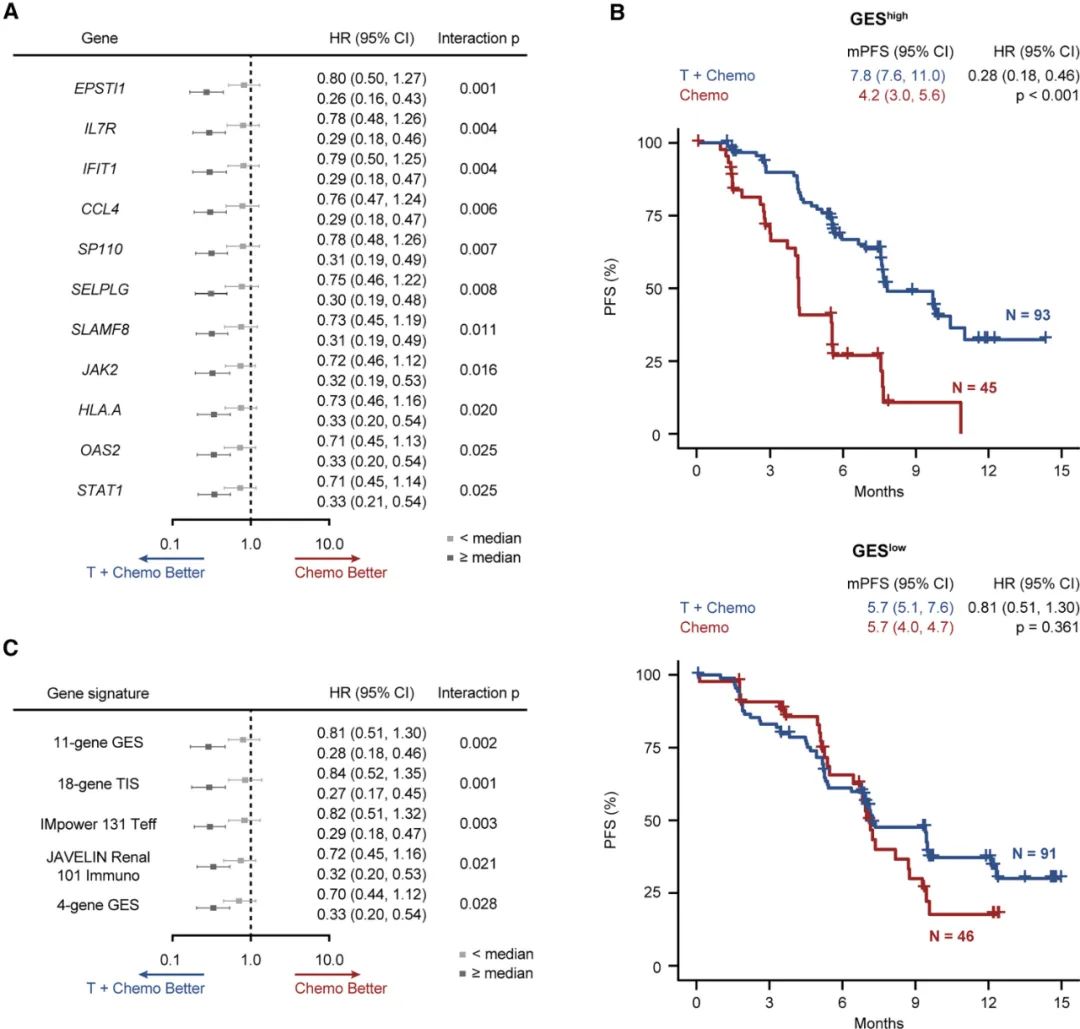
11基因特征及其表达水平与患者PFS的相关性
研究团队还以其它临床研究(JAVELIN Renal 101)、中国医学科学院肿瘤医院本院患者队列和外部真实世界NSCLC患者队列[3]数据,多次对经筛选出的11个基因特征可靠性进行了验证,确认这套基因特征可用于预测不同模式免疫治疗,即免疫单药、免疫+化疗或免疫+抗血管生成药物联合治疗方案的获益,且与其它研究提出的基因特征表现有一致性。
本次研究的第二部分则是试图探寻PD-L1表达水平和TMB水平,不能有效预测免疫+化疗方案疗效的原因,为此研究者们分析了PD-L1阳性及tTMB高的患者,发现这部分患者中有25%合并了NRF2通路基因的共突变,且仅有这类共突变与患者PFS负相关(HR=1.91, p=0.006);而在免疫+化疗组全部患者中,NRF2野生型患者的预后也明显优于突变型(HR=0.52, p=0.008)。
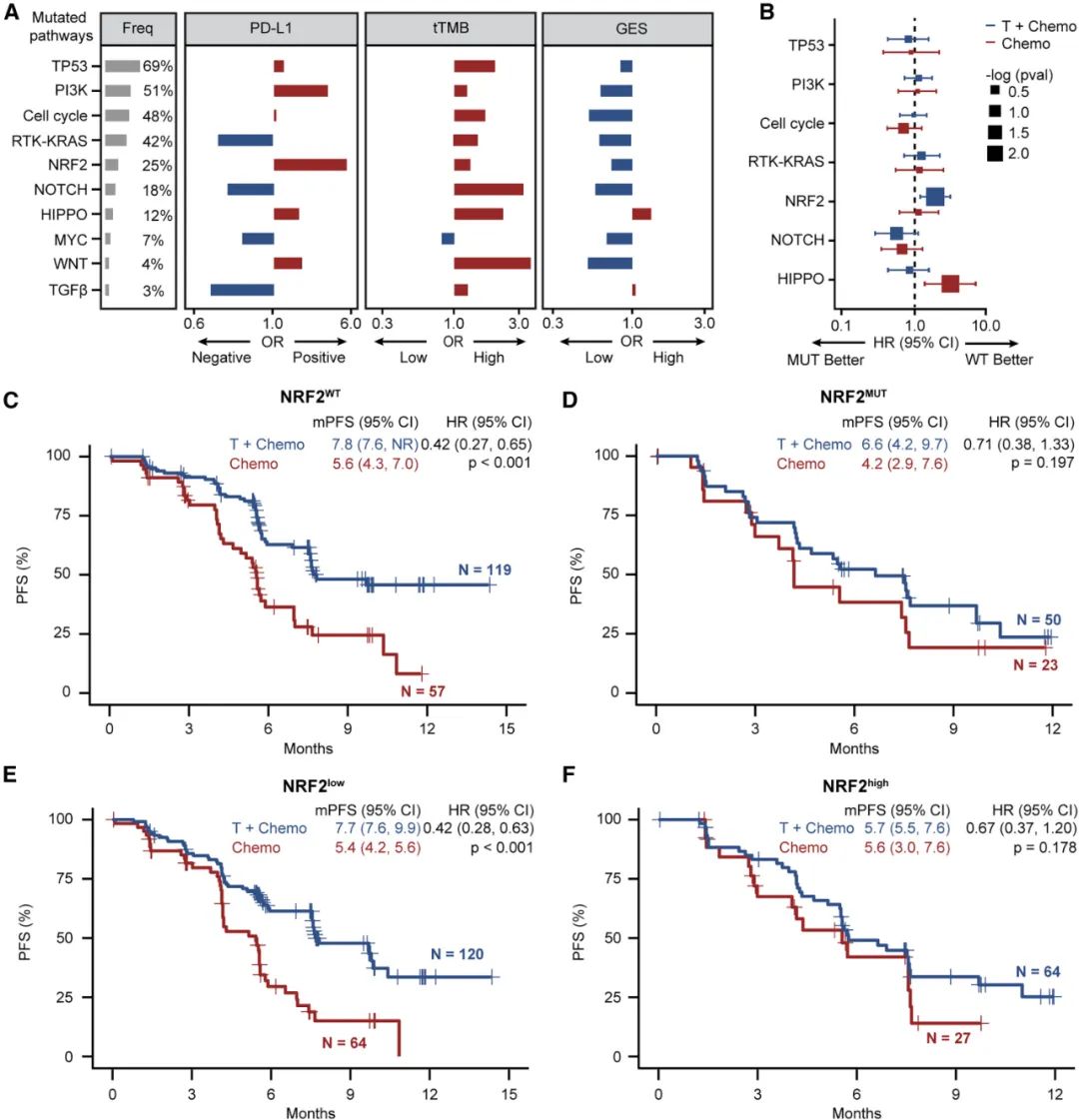
NRF2通路基因突变状态与患者PFS的相关性
进一步分析显示,NRF2的影响在PD-L1阳性、tTMB高水平患者中相对明显,但在前文所述的11基因特征高表达患者中不明显,因此研究团队猜想NRF2可能直接影响了PD-L1的表达水平,并证实在肺鳞癌细胞中,NRF2可直接结合到PD-L1基因的启动子区域,以实现相对独立的调控,且这种调控作用在11基因特征低表达的非炎症性冷肿瘤中占据主导地位。换句话说,NRF2会“强行拉高”冷肿瘤中的PD-L1表达水平,但这对免疫治疗不见得有利。

NRF2对PD-L1表达水平的调控作用
总而言之,本次研究的两部分恰好能从两个方面助力肺鳞癌的精准免疫治疗,一方面是由11个基因组成的基因特征指导精准用药,但这还需要更多前瞻性、大规模研究的验证;另一方面则是揪出了可能不利于免疫治疗的NRF2通路,希望后续科研工作能尽快找到破解它的方法吧。
参考文献:
[1]Duan J, Zhang Y, Chen R, et al. Tumor-immune microenvironment and NRF2 associate with clinical efficacy of PD-1 blockade combined with chemotherapy in lung squamous cell carcinoma[J]. Cell Reports Medicine, 2023.
[2]Wang J, Lu S, Yu X, et al. Tislelizumab plus chemotherapy vs chemotherapy alone as first-line treatment for advanced squamous non–small-cell lung cancer: a phase 3 randomized clinical trial[J]. JAMA Oncology, 2021, 7(5): 709-717.
[3]Hwang S, Kwon A Y, Jeong J Y, et al. Immune gene signatures for predicting durable clinical benefit of anti-PD-1 immunotherapy in patients with non-small cell lung cancer[J]. Scientific Reports, 2020, 10: 643.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


