Nature子刊:肥胖的结直肠癌患者的脂肪因子机制研究
来源:本站原创 2021-09-08 09:44
肥胖是癌症恶化的一个重要风险因素,与肥胖相关的癌症是导致死亡的主要原因之一。
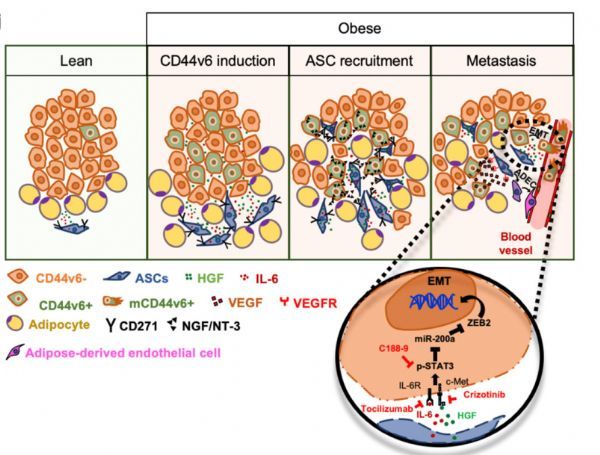
肥胖是癌症恶化的一个重要风险因素,与肥胖相关的癌症是导致死亡的主要原因之一。然而,在受肥胖影响的患者中,赋予癌细胞转移特性的分子机制仍未被探索。在这里,作者发现肿瘤邻近的内脏脂肪基质细胞(V-ASCs)分泌IL-6和HGF,扩大转移性结直肠(CR)癌细胞室(CD44v6 +),而CD44v6 +又分泌神经营养因子,如NGF和NT-3,并招募肿瘤肿块内的脂肪干细胞。内脏脂肪源性因子通过激活STAT3促进血管生成和转移扩散,抑制miR- 200a并提高ZEB2的表达,有效地将CRC细胞重编码为高转移表型。
值得注意的是,肥胖相关肿瘤微环境引发了来自上皮共识分子亚型(CMS2) CRC患者的细胞转录组表达谱向间充质亚型(CMS4)的转变。STAT3通路抑制降低了ZEB2的表达,并破坏了脂肪释放蛋白维持的转移性生长。总之,该研究表明,针对肥胖的结直肠癌患者的脂肪因子可能代表一种预防转移性疾病的治疗策略。
图片来源: https://doi.org/10.1038/s41467-021-25333-9
直肠癌(CRC)是全球第三大常见的癌症相关死亡原因. 尽管在CRC的研究方面做出了巨大的努力,但其转移过程的分子机制仍然不清楚。越来越清楚的是,在全球范围内日益流行的肥胖与癌症发病率有关,并导致高达20%的癌症相关死亡。在肥胖状态下,皮下和内脏白色脂肪组织都因原有脂肪细胞的肥大而扩大。
最近的证据表明,在高脂饮食诱导的肥胖小鼠模型中,内脏脂肪决定了一个由脂肪前体细胞(鉴定为Lin /Sca1+/CD29 +/ CD34 +)驱动的增生性反应。这种现象可能是由于皮下和内脏脂肪组织的胚胎起源不同,以及/或特定的滞留因子的存在,正如在成年Wt1-GFP敲入小鼠中进行的谱系追踪实验所强调的那样。特别是成熟的脂肪细胞是有丝分裂后的细胞,提示增生是由脂肪细胞前体的扩张和分化引起的。成熟脂肪细胞和脂肪基质细胞(ASCs)通过释放过多的炎症和血管生成细胞因子来影响周围的细胞群。
在受肥胖影响的个体中,脂肪释放蛋白,包括TNF-α、IL-6和单核细胞趋化蛋白1 (MCP1),促进了一种慢性炎症状态,创造了一种能够维持肿瘤进展的微环境。在由肥胖释放的蛋白质存在的情况下,各种类型的癌症会激活细胞增殖过程,并表现得更具攻击性。已经确定的是,包括结肠在内的癌症起源于一小部分具有干细胞样特征的细胞,称为癌症干细胞(CSCs),其表型和行为可由肿瘤微环境(TME)节。
ASCs和CRC细胞之间双向串扰的示意图
图片来源: https://doi.org/10.1038/s41467-021-25333-9
最近,TME细胞因子,如IL-6和HGF,被证明具有临床相关性,并诱导癌细胞干化,同时增强上皮-间充质转化(EMT)、细胞迁移和转移潜能。CRC细胞和TME之间的相互作用是解决癌细胞命运的基础,这是肿瘤生物学行为的特征。
一致地,CRC可以根据其分子特征分为四种共识分子亚型(CMS),这部分取决于TME的组成,并预测临床结果。一致地,CRC可以根据其分子特征分为四种共识分子亚型(CMS),这部分取决于TME的组成,并预测临床结果。值得注意的是,14%的crc表现为过渡或混合表型。动态CRC微环境可诱导CMS可塑性,从而形成临床结果,但研究较少。
在这项工作中,作者通过重编程CMS,研究了VAT在CRC细胞间质表型调控中的旁分泌效应。该研究发现,在肥胖的CRC患者中,肿瘤浸润性ASCs是癌症进展的关键因素。CRC细胞释放的NGF和VEGF诱导内皮细胞表型ASC转分化。此外,该研究还表明,IL-6和HGF增强了CRC细胞的致瘤和转移潜能,表明微环境细胞因子是预测肥胖相关癌症患者肿瘤行为的重要预后分子。(生物谷
Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。