《自然》为治疗肥胖引起的两大疾病指出新靶点
来源:学术经纬 2020-03-08 09:14
6日,顶尖学术期刊《自然》新上线的一篇研究论文中,耶鲁大学的科学家通过阐明胰高血糖素在调节肝脏能量代谢中的分子机制,为两种在全世界影响人数众多的代谢疾病带来了新见解。研究机构的新闻称,“这一发现对糖尿病和非酒精性脂肪性肝病(NAFLD)的治疗有重要意义”。在肥胖流行的背景下,2型糖尿病和非酒精性脂肪性肝病正在变得越来越常见。2型糖尿病目前影响了全球2亿多患者
6日,顶尖学术期刊《自然》新上线的一篇研究论文中,耶鲁大学的科学家通过阐明胰高血糖素在调节肝脏能量代谢中的分子机制,为两种在全世界影响人数众多的代谢疾病带来了新见解。研究机构的新闻称,“这一发现对糖尿病和非酒精性脂肪性肝病(NAFLD)的治疗有重要意义”。
在肥胖流行的背景下,2型糖尿病和非酒精性脂肪性肝病正在变得越来越常见。
2型糖尿病目前影响了全球2亿多患者,由于对胰岛素产生抵抗,患者无法有效控制血糖水平。而NAFLD是肝细胞脂肪堆积而导致的慢性肝病,据估算在全世界影响了25%的人口,也是中国的头号肝病。NAFLD从单纯性肝脂肪变为非酒精性脂肪性肝炎(NASH),逐渐引起肝纤维化,最终可能发展为肝硬化、肝功能衰竭甚至肝癌!
负责这项研究的Gerald Shulman教授是知名的内分泌学家,多年的研究经验让他发现,2型糖尿病和NAFLD在分子机制上有相似之处,都涉及肝脏中能量产生与使用之间的微妙平衡。
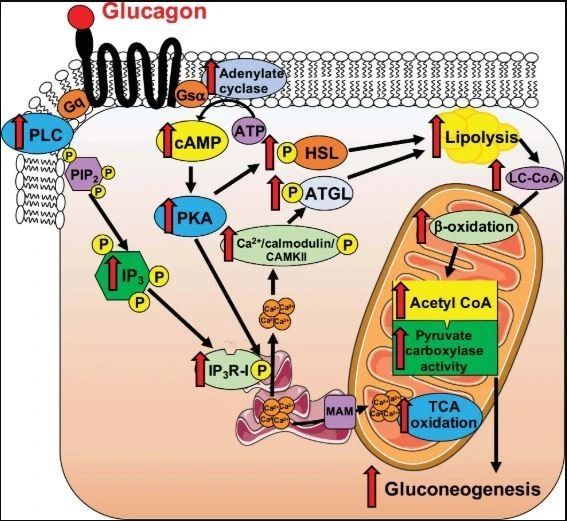
这支研究团队从胰高血糖素入手。这是一种由胰腺分泌的激素,在代谢中发挥重要作用。当身体缺少食物时,胰高血糖素可以发动肝脏在一系列酶的作用下产生葡萄糖,从而为身体组织、尤其是大脑提供必不可缺的燃料。这个过程被称为肝糖异生(gluconeogenesis)。
基于对胰高血糖素在糖尿病发病机理中的明确作用,过去人们尝试通过阻断这种激素来降低过高的血糖水平。然而实验性的治疗方法导致潜在的严重副作用,通过未知的机制增加了肝脏内酶的积累,意味着脂肪肝风险,也表明胰高血糖素除了引起肝糖异生,还有促进肝内脂肪分解的作用。
在这项新研究中,科学家们关注了一种已知与线粒体活性有关的蛋白,1型三磷酸肌醇受体(简称INSP3R1)。线粒体被称为细胞内的能量工厂,脂肪等物质在这里氧化产生能量分子。
他们发现,胰高血糖素会增加肝细胞的线粒体氧化能力。但在肝脏缺乏INSP3R1的基因敲除小鼠中,这种现象没有出现。通过进一步实验发现,在这个过程中,激活的INSP3R1通过影响线粒体内的钙信号来影响脂肪氧化。
另一方面,在禁食后耗尽肝糖原的状态下,急性输入大量胰高血糖素,会刺激肝脏生成葡萄糖,这一过程同样有赖于INSP3R1蛋白,并且INSP3R1通过调节细胞内的钙信号通路影响糖异生过程。
基于INSP3R1介导的钙信号在这一平衡中所起的作用,“我们把线粒体的钙转运确认为促进胰高血糖素发挥积极作用的潜在目标,以此提高肝细胞线粒体的脂肪氧化,逆转NAFLD,同时避免刺激糖异生。”第一作者Rachel Perry教授解释说。
为此,研究人员尝试了慢性增加血液内胰高血糖素的方式,治疗因高脂肪饮食而肥胖的脂肪肝大鼠。经过10天的连续输注,大鼠肝脏的线粒体氧化速率增加1倍,肝脏脂肪含量减少,并且改善了葡萄糖耐受程度。
在肥胖小鼠模型上,连续3.5周的胰高血糖素慢性输注也获得了逆转NAFLD的类似结果,甘油三酯、甘油二酯降低50%~80%。然而,在肝脏缺乏INSP3R1的基因敲除小鼠身上,给予胰高血糖素并不能改善肝脂肪变性和胰岛素抵抗,显示了INSP3R1在此过程中的关键作用。
研究者在论文中总结说:“这些结果为胰高血糖素生物学提供了新的见解,并提示我们,由INSP3R1介导的线粒体钙转运过程或许是逆转非酒精性脂肪性肝病和2型糖尿病的治疗新靶点。”我们期待科学家后续通过临床研究检验这种策略的可行性,为广大患者人群带来新的治疗选择。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


