挑战常规!Nature及其子刊首次揭示转录偶联修复在细菌DNA损伤修复中起着至关重要的作用
来源:生物谷原创 2022-04-11 11:44
与传统观点相反的是,第一项研究发现RNA聚合酶是整个NER复合物组装的支架,也是DNA损伤的主要传感蛋白。
DNA分子很容易受到细胞代谢的反应副产物、毒素和紫外线的损害。鉴于受损的DNA可导致有害的DNA和细胞死亡,细胞进化出了DNA修复机制。然而,该领域一个尚未解决的主要问题是,这些修复机制如何在未受损伤的DNA的“广阔领域”中迅速搜索并找到罕见的损伤区域。
过去的研究已发现,一种重要的搜索机制---转录偶联修复(transcription-coupled repair, TCR)---依赖于RNA聚合酶。RNA聚合酶是一种大型蛋白复合物,在将DNA中携带的指令转录到RNA分子中时读取DNA碱基代码,随后转录后所产生的RNA指导蛋白表达。然而, TCR机制被误解了。
被人广泛接受的研究工作认为TCR在修复中发挥的作用相对较小,因为它依赖于一个推定的TCR因子,而该因子对DNA修复的贡献微乎其微。作为一种平行的过程,全基因组修复(global genome repair, GGR)被认为可以扫描和修复大部分独立于转录的DNA。这两种过程被认为是为核苷酸切除修复(nucleotide excision repair, NER)奠定了基础,而在NER中,受损的DNA片段被切掉并被一个准确的拷贝所替换。
如今,两项新的研究为细菌细胞如何不断修复它们的DNA中的受损部分提供了一个全新的画面。它们基于对活的大肠杆菌细胞中DNA修复的首次多阶段分析,认为如果不是全部的话,大部分的NER是与RNA聚合酶偶联的,而RNA聚合酶扫描整个细菌遗传密码中的损伤。第一项研究发表在2022年4月7日的Nature期刊上,论文标题为“Crucial role and mechanism of transcription-coupled DNA repair in bacteria”。第二项研究于2022年3月30日发表在Nature Communications期刊上,论文标题为“Pervasive Transcription-coupled DNA repair in E. coli”。
作为这两篇论文的通讯作者,纽约大学朗格尼医学中心生物化学与分子药理学系教授Evgeny Nudler博士说,“根据我们的研究结果,我们需要重新思考DNA修复领域的一些基本理论。真正了解这类修复是医学上的一个基本目标,因为大多数抗生素和化疗药物通过破坏致病细胞的DNA来杀死它们,而阻止修复的能力将使这些细胞更容易受到现有药物的伤害。”
发现管道
过去的研究不能完全捕捉细菌中NER的生物学现实,因为它们开展的实验试图在活细胞外重建复杂的蛋白相互作用。例如,这导致该领域将一种名为Mfd的蛋白定义为TCR的核心角色,即使发现无论Mfd是否存在,大多数DNA修复都在进行。这反过来提示着TCR是一种次要的修复途径。人们还认为TCR只发生在高转录的DNA区域内。很少转录的基因组区域,或者说被认为是“非转录”的基因组部分,被认为会受到GGR的影响。
第一项研究使用了一种称为交联质谱(crosslinking mass spectrometry, XLMS)的突破性技术来绘制化学连接蛋白(chemically linked protein)之间的距离,从而首次确定了在活细胞中组装的大量NER和聚合酶复合物的相互作用表面。然后,作者将光谱数据输入计算机驱动的模拟,最终得到真实的结构模型。
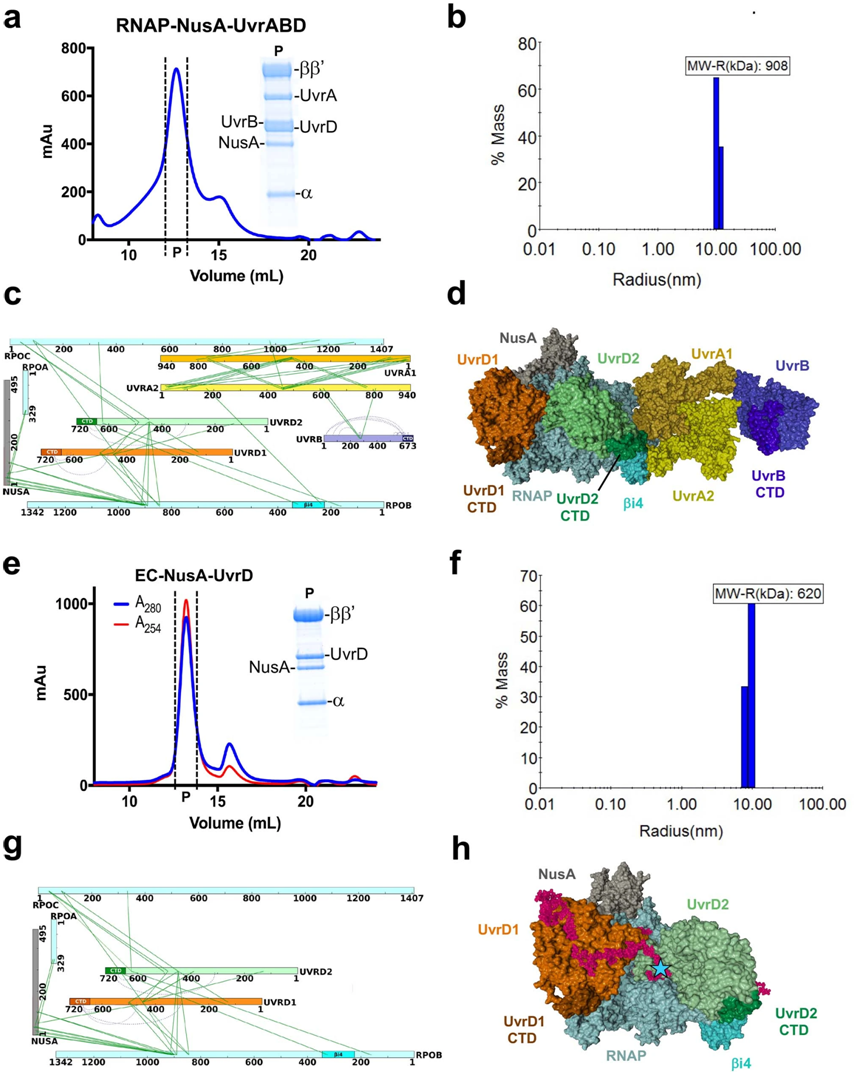
XLMS驱动的TCR复合物(TCRC)结构建模。图片来自Nature, 2022, doi:10.1038/s41586-022-04530-6。
与传统观点相反的是,第一项研究发现RNA聚合酶是整个NER复合物组装的支架,也是DNA损伤的主要传感蛋白。它证实主要的NER酶UvrA和UvrB并不能自我定位大多数损伤位点,而是由RNA聚合酶将它们递送到这些损伤位点。作者说,这种基本的TCR过程并不依赖于Mfd。
第二项研究也是在活细胞中进行的,利用一种叫做CPD-seq的高通量测序技术在单碱基分辨率下追踪暴露在紫外线下的DNA出现的损伤,以及修复损伤的速度。CPD-seq显示,使用抗生素利福平(rifampicin)干扰细菌转录,会关闭整个细菌基因组的修复。这些研究结果认为,NER与细菌染色体各处的转录紧密偶联。
在另一个引人注目的飞跃中,实验显示,细菌细胞在面对DNA损伤时,会抑制蛋白Rho的作用,其中Rho是一种告诉RNA聚合酶停止读取的全局终止信号。随着停止信号的减弱,RNA聚合酶不断地读取,将这些修复酶送到整个基因组中任何发生DNA损伤的地方。
作为第一篇论文的共同第一作者,Nudler实验室博士后学者Binod Bharati博士说,“鉴于我们的发现,我们推测真核生物,包括人类细胞,也使用RNA聚合酶在全局范围内进行高效修复,因为这两篇论文中描述的细菌TCR复合物有人类的类似物。展望未来,我们的团队计划确认人类细胞中是否存在全局TCR,如果得到确认,将探索在未来是否可以安全地促进修复以对抗衰老疾病。” (生物谷 Bioon.com)
参考资料:
1. Binod K. Bharati et al. Crucial role and mechanism of transcription-coupled DNA repair in bacteria. Nature, 2022, doi:10.1038/s41586-022-04530-6.
2. Britney Martinez et al. Pervasive Transcription-coupled DNA repair in E. coli. Nature Communications, 2022, doi:10.1038/s41467-022-28871-y.
3. Researchers discover new model for 'global' DNA repair
https://phys.org/news/2022-03-global-dna.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


