术后粘连性小肠梗阻防治陷困境?Adv Sci新突破:BMSC水凝胶重编程成纤维细胞+阻纤维化通路,恢复肠道功能
来源:生物谷原创 2025-11-24 14:36
本研究证实骨髓间充质干细胞水凝胶可通过重编程成纤维细胞表型、分泌外泌体抑制炎症并阻断TGF-β1/Smad3通路,有效恢复粘连性小肠梗阻的肠道功能,为临床防治该疾病提供新策略。
腹部手术后,粘连性小肠梗阻(ASBO)是普外科医生常面临的急危并发症,浆膜损伤引发异位成纤维细胞激活,进而导致肠道狭窄,不仅发病率和死亡率居高不下,疾病复发还会给患者家庭与社会带来沉重经济负担。目前临床上常用的微创术式、防粘连屏障等预防手段,要么效果不理想,要么易引发操作受限、异物反应等不良反应,始终未能突破治疗瓶颈。
近日,Adv Sci刊载的福建医科大学附属协和医院等团队的研究Bone Marrow Mesenchymal Stem Cell Hydrogel-Mediated Fibroblast Reprogramming Restores Intestinal Function in Adhesive Small Bowel Obstruction为解决这一临床难题带来关键突破:包封骨髓间充质干细胞的丝素水凝胶(BMSC@Gel)不仅能预防组织粘连,还可在小鼠模型与人源类器官中精准恢复肠道生理功能,核心在于对梗阻肠道微环境的双重调控。

研究团队首先从小鼠股骨中提取骨髓间充质干细胞(BMSCs),这类细胞高表达CD29、CD44等间充质标志物,低表达CD45、CD11b等造血标志物,且具备成骨、成脂分化能力,符合干细胞治疗的核心标准。基于此构建的BMSC@Gel递送系统,可实现干细胞的时间依赖性释放,12天后释放率超50%;同时水凝胶在体内具有14天的可控降解动力学,能持续维持干细胞高活力,生物安全性经多维度验证无虞。
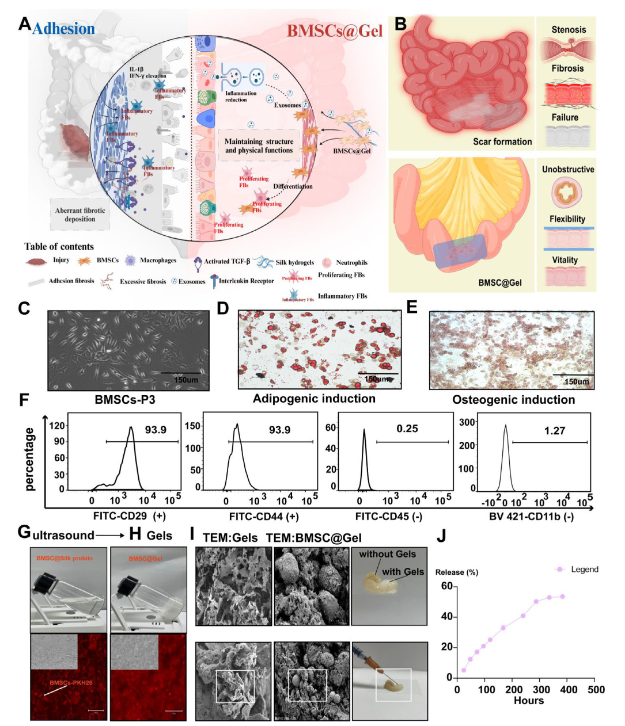
图1:骨髓间充质干细胞的鉴定及载干细胞水凝胶系统的体外验证
在体内治疗效果评估中,接受BMSC@Gel处理的ASBO小鼠模型,粘连带数量显著减少,Nair粘连评分(评估粘连严重程度的核心指标)大幅降低,生存率明显提升。组织学分析显示,该水凝胶能完整维持肠浆膜结构,减少黏膜层腺体破坏,显著逆转组织变性、炎症细胞浸润、坏死与增生等病理改变;更能抑制胶原纤维异常沉积,从根源上减轻肠壁纤维化与管腔狭窄。对比单独BMSC治疗、泼尼松龙等传统疗法,BMSC@Gel的治疗效能优势更为突出。
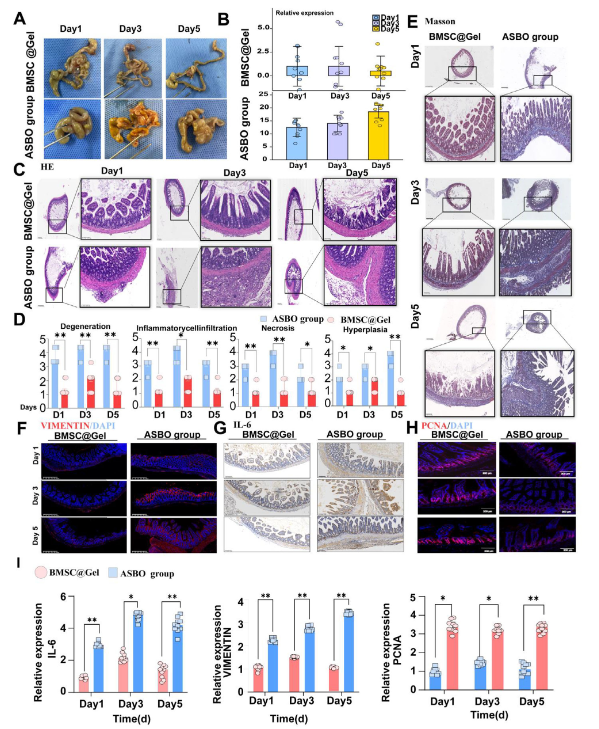
图2:骨髓间充质干细胞水凝胶通过增强组织修复、调控炎症反应与肠道稳态减轻术后肠梗阻
进一步研究发现,BMSC@Gel的作用不止于解决机械性梗阻,更能修复肠道深层生理功能损伤。通过PKH26标记追踪观察到,BMSCs会从肠浆膜层逐步迁移至黏膜层,在此过程中,肠道黏膜完整性标志物(CDX2、CDH1)、肠内分泌系统关键分子(CHGA)、细胞增殖指标(Ki67)与黏液分泌相关蛋白(MUC2)等关键生理指标的表达均恢复正常。更重要的是,在人源肠道类器官模型中,该水凝胶同样能修复肠黏膜干细胞分化障碍,维持黏膜基本结构与功能,证明其治疗效果具有跨物种稳定性。

图3:骨髓间充质干细胞的迁移与肠道功能维持
研究者还揭示,BMSCs分泌的外泌体是其发挥治疗作用的重要媒介。这些外泌体直径为50-110纳米,表达TSG101、CD81、CD63等特征标志物,能被肠上皮细胞高效摄取,并以剂量依赖方式促进细胞增殖与伤口愈合。同时,BMSC@Gel可改变外泌体蛋白质组构成,术后1、3、5天分别上调306、335、163种蛋白,下调215、308、133种蛋白;通过抑制IL-1、IFN-γ等促炎因子释放,调控细胞间隙连接与紧密连接通路,减少Col6a1、Col6a2等异常修复相关蛋白表达,最终缓解肠道炎症微环境,避免过度纤维化。
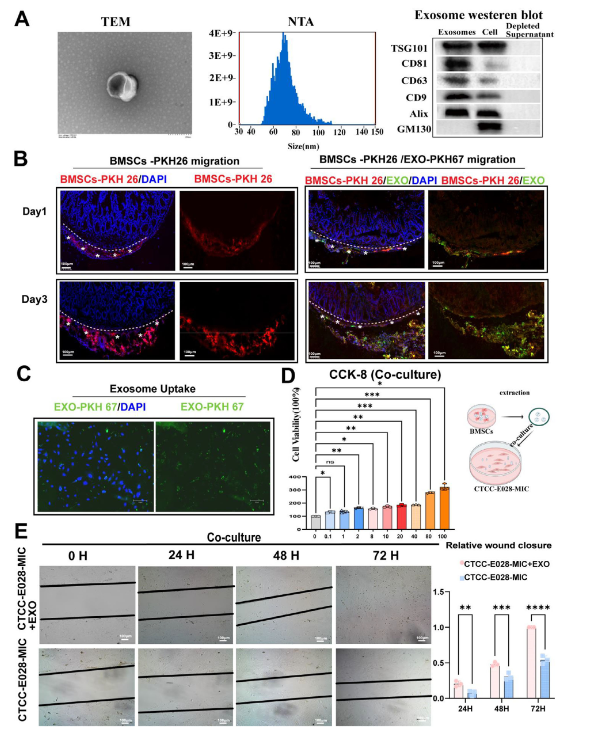
图4:骨髓间充质干细胞来源外泌体促进肠上皮再生的鉴定与功能分析
借助单细胞RNA测序技术,研究团队进一步解析了BMSC@Gel对成纤维细胞表型的重编程作用:它能显著抑制以Adamdec1、Mmp3、Igfbp3为标记的炎性成纤维细胞,同时促进以Top2a、Stmn1、Spp1为标记的增殖性成纤维细胞生成。更关键的是,增殖性成纤维细胞会跟随BMSCs的迁移轨迹从浆膜向浆膜下层移动,逐步替代炎性成纤维细胞参与组织修复——炎性成纤维细胞通过促炎趋化因子轴加剧炎症与纤维化,而增殖性成纤维细胞则通过Tgfb2/3-Tgfbr1/2、Jag1-Notch2等通路促进平滑肌与上皮细胞增殖,同时抑制细胞凋亡,形成“抑炎-修复”良性循环。
最终研究证实,TGF-β1/Smad3信号通路是BMSC@Gel发挥作用的关键靶点。无论是小鼠模型还是人源ASBO类器官,BMSC@Gel都能显著降低TGF-β1与SMAD3的表达,直接阻断纤维化进程,从根源上逆转ASBO的发生与发展。

图5:TGF-β/Smad3信号轴在粘连性小肠梗阻发病机制中起关键作用
这项研究系统阐明了BMSC@Gel在ASBO治疗中的核心机制与应用价值:它通过三重关键作用实现肠道全面修复——重编程成纤维细胞表型、分泌外泌体调控炎症微环境、抑制TGF-β1/Smad3纤维化通路,最终同时恢复肠道的机械结构与生理功能。相比传统防粘连手段仅靠物理隔离的局限,BMSC@Gel是具备生物活性修复能力的新型治疗策略,不仅为ASBO的预防与治疗提供新方向,也为术后腹腔粘连相关疾病的生物治疗研发奠定基础。未来随着该技术的临床转化,有望大幅降低术后肠梗阻的发生率与复发率,既减轻患者病痛,也缓解医疗系统负担。(生物谷Bioon.com)
参考文献:
Zheng L *, Zhang J *, Huang Z *, et al. Bone Marrow Mesenchymal Stem Cell Hydrogel-Mediated Fibroblast Reprogramming Restores Intestinal Function in Adhesive Small Bowel Obstruction. Adv Sci (Weinh). Published online October 27, 2025. doi:10.1002/advs.202513781
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


