破局之“法”!通过重构宫颈癌供血系统,法米替尼“一箭双雕”,既直接抗癌又协同增效免疫治疗
来源:奇点糕 2025-10-16 09:59
总的来说,由于对三种重要促血管生成受体酪氨酸激酶的强效抑制作用,让法米替尼不仅有直接抗肿瘤能力,还通过重塑肿瘤血管系统和免疫微环境,增强了免疫检查点抑制剂卡瑞利珠单抗的抗癌效果。
我国晚期宫颈癌患者,终于迎来了一种新疗法。
国家药品监督管理局(NMPA)正式批准法米替尼+卡瑞利珠单抗联合疗法上市,用于治疗既往经过含铂化疗、但未经过贝伐珠单抗治疗的复发/转移性宫颈癌患者[1]。
此次获批基于2期临床研究SHR-1210-II-217的数据,从最新研究数据来看,法米替尼联合卡瑞利珠单抗治疗组对于未经过贝伐珠单抗治疗的患者的客观缓解率(ORR)达到44.6%;中位无进展生存期(mPFS)为6.4个月;中位总生存期(mOS)更是达到了创纪录的20.2个月[2]。

SHR-1210-II-217研究论文首页截图[2]
不难看出,这一联合治疗方案的数据刷新了我国宫颈癌二线治疗生存期的记录,为我国晚期宫颈癌患者带来长生存希望。要想搞清楚法米替尼联合卡瑞利珠单抗为何能取得如此优异的疗效,还得从宫颈癌的治疗史说起。
1981年,顺铂的引入是晚期宫颈癌治疗的第一个转折点[3],但是患者的总生存期仍未达到1年[4]。三十三年后,抗血管生成药物将复发/转移性宫颈癌患者的mOS提升到17个月,将患者的死亡风险降低了29%[5],化疗联合抗血管生成药物也成为首选一线治疗方案[6]。不过,绝大部分患者仍会复发,这些治疗后进展的患者,又面临无药可医的局面。2018年,虽然免疫检查点抑制剂获批复发/转移性宫颈癌的二线治疗[7],但是单药疗效非常有限,即使联合其他药物ORR也只停留在0%-31.8%之间[8-11]。
正是在这样的大背景下,抗血管生成的法米替尼联合PD-1抑制剂卡瑞利珠单抗这一方案就诞生了。法米替尼是一种新型多靶点受体酪氨酸激酶抑制剂(TKI),能够靶向VEGFR2、PDGFRβ和c-Kit等多个靶点。在介绍它的威力之前,我们先要回顾下肿瘤的血管生成,因为法米替尼发挥作用与血管生成密不可分。

我们都知道,肿瘤代谢旺盛、增殖迅速,因此它对氧气和营养物质有极大的需求。早在十九世纪,科学家就观察到了肿瘤生长伴随着血管的增加[12]。直到1968年,科学家才首次证实肿瘤细胞确实能释放血管生成因子,促进肿瘤的生长[13,14]。
因此,三年之后,哈佛医学院的Judah Folkman就提出了——开发血管生成抑制剂治疗癌症的创新想法[15]。在此之后,科学家找到了大量与肿瘤血管生成相关的信号通路,受体酪氨酸激酶c-Kit、VEGFR2和PDGFRβ就是其中的三个。
VEGF是调节肿瘤血管生成的典型细胞因子,它在与受体酪氨酸激酶VEGFR结合之后,会激活血管内皮细胞的生长和生存,以及血管生成相关的典型下游信号通路(如PI3K/AKT/mTOR等),进而促进血管的生成,以及肿瘤的生长和转移[16]。有研究表明,在病理性血管生成中,最关键的信号通路是VEGF-A/VEGFR2,它可以促进内皮细胞的分裂和形态发生,并诱导癌细胞的增殖、迁移、侵袭和瘤内血管生成[17]。
在宫颈癌中,HPV病毒编码的致癌蛋白E6和E7,分别会导致抑癌蛋白p53的降解和pRb的失活,进而导致VEGF表达上调,从而驱动肿瘤血管生成[18]。我国西京医院团队的一项研究发现,81.0%的宫颈癌患者存在VEGFR2中/高水平表达;而且,VEGFR2高表达预示着OS较差[19]。因此,阻断VEGF/VEGFR信号通路,就有抑制宫颈癌进展的作用,抗VEGF抗体的成功,就是最好的证据。体外研究表明,法米替尼对VEGFR2有较强的抑制活性,IC50值为4.7nM[20]。
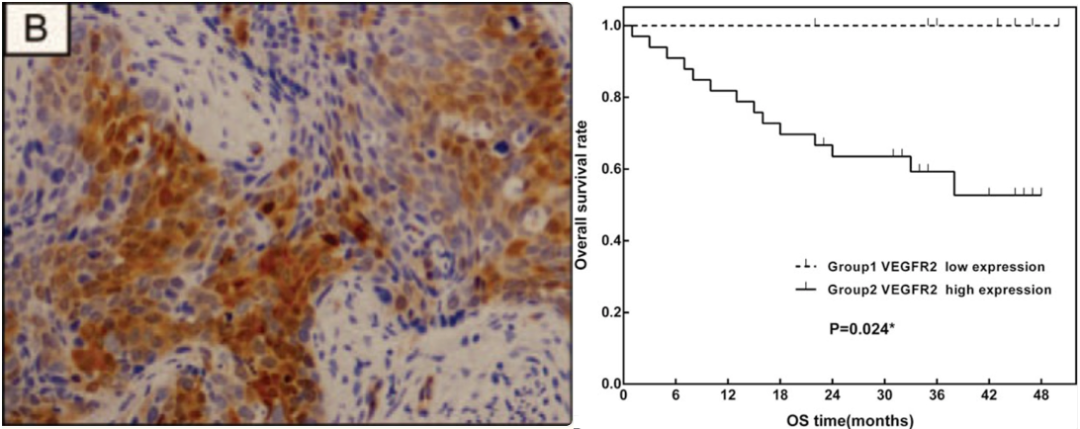
VEGFR2在宫颈癌中高表达且与OS密切相关[19]
虽然抗VEGF单抗取得了一些积极成果,但临床获益并未达到预期,患者的PFS率改善不大,OS率改善甚微,甚至在一些治疗失败的病例中,患者遭受的毒性反应药远远大于治疗效果[16]。正如前文所言,肿瘤的血管生成受多条通路控制,因此肿瘤可以通过其他通路逃避单一抗VEGF单抗的治疗作用。
PDGFR和它的配体PDGF,也在肿瘤血管生成中发挥重要作用。它们是血管生成过程中,募集周细胞的关键信号通路,对血管发育、稳定、成熟和重塑有至关重要的作用[21]。
在这条信号通路中,被研究最多的当属PDGF-BB/PDGFRβ,它可以调控MAPK/ERK、PI3K/AKT和JNK等重要促癌通路,可促进癌细胞的增殖和转移[22]。此外,PDGFRβ还通过影响细胞与细胞外基质结构之间的张力,参与间质压力的调节[23]。要知道,由于不规则的血管生成导致肿瘤血管发育异常,大多数恶性肿瘤的间质压力都会升高,这给抗癌药物从血液循环中进入肿瘤造成了生理障碍[23]。
已经有研究发现,52.7%的宫颈癌肿瘤细胞PDGFRβ呈阳性,62.5%的宫颈癌细胞系表达PDGFB[23];而且,科学家已经发现,宫颈癌患者肿瘤组织的间质压力增加[24]。值得注意的是,有研究表明,特异性抑制PDGFRβ活性可显著降低PDGF-BB高表达肿瘤的生长和血管生成[25]。体外研究结果显示,法米替尼对PDGFRβ也有较强的抑制活性,IC50值为6.6nM[20],远低于其他TKIs。
52.7%的肿瘤细胞中PDGFRβ呈阳性[23]
值得注意的是,来自瑞典卡罗林斯卡医学院的研究人员发现,同时抑制VEGF和PDGFR可以发挥协同作用:抑制PDGFRβ会阻断周细胞的募集,从而使血管暴露于VEGF抑制剂,进而抑制血管萌发并加剧肿瘤缺氧,达到更强的抑瘤作用[26]。
除了能阻断VEGF和PDGFR通路之外,法米替尼还可以抑制受体酪氨酸激酶c-Kit的活性。在被配体干细胞因子(SCF)激活后,c-Kit可促进血管平滑肌细胞的生存并抑制凋亡,还可以激活促血管生成反应,增强内皮细胞的迁移能力和毛细血管的形成;而c-Kit缺失,则会阻碍血管内皮干细胞的增殖,并抑制体内血管生成[27]。
一项来自中国的研究发现,在宫颈癌中,c-Kit的表达随宫颈癌分化程度降低而升高,这说明c-Kit与宫颈癌的侵袭能力有关[28]。法米替尼对c-Kit的抑制活性超强,IC50值仅为2.3nM[20],是其他TKIs的数倍到数百倍。
法米替尼对VEGFR2、PDGFRβ和c-Kit等与血管生成密切相关的受体酪氨酸激酶,有强效抑制能力,就是法米替尼联合卡瑞利珠单抗能刷新晚期宫颈癌二线治疗生存期纪录的关键原因之一。
除了可以直接抗癌之外,近年来,科学家发现,抗血管生成药物其实可以平衡肿瘤微环境中的抗血管生成信号与促血管生成信号,进而促使肿瘤血管正常化,重塑肿瘤血管和免疫微环境,最终增效免疫检查点抑制剂的抗癌能力[29]。而抗血管药物法米替尼与免疫检查点抑制剂卡瑞利珠单抗的组合,恰好实现了上述的协同增效作用,这也是这一组合疗法表现优异的第二个重要原因。
总的来说,由于对三种重要促血管生成受体酪氨酸激酶的强效抑制作用,让法米替尼不仅有直接抗肿瘤能力,还通过重塑肿瘤血管系统和免疫微环境,增强了免疫检查点抑制剂卡瑞利珠单抗的抗癌效果。在上述机制的加持下,这一联合治疗方案,进一步给患者带来了有临床意义的生存获益,而且没有增加新的不良反应谱。
值得期待的是,在二线治疗取得成功的法米替尼+卡瑞利珠单抗没有止步,而是正在往一线治疗进发。目前,随机对照、开放标签、多中心III期临床研究SHR-1210-III-329正在积极推进中[30],这个研究在探索这一组合疗法一线治疗复发/转移性宫颈癌的疗效和安全性。如果这一联合疗法在复发/转移性宫颈癌一线治疗中获得阳性结果,将会开启复发/转移性宫颈癌治疗的“去化疗”新时代。
参考文献:
[1].https://www.nmpa.gov.cn/zhuanti/cxylqx/cxypxx/20250529152509182.html
[2].Xia L, Zhang K, Tang Y, et al. Camrelizumab Plus Famitinib versus Camrelizumab Alone and Investigator's Choice of Chemotherapy in Recurrent or Metastatic Cervical Cancer: A Randomized, Phase II Study. J Clin Oncol. 2025;43(24):2720-2733. doi:10.1200/JCO-24-02495
[3].Thigpen T, Shingleton H, Homesley H, Lagasse L, Blessing J. Cis-platinum in treatment of advanced or recurrent squamous cell carcinoma of the cervix: a phase II study of the Gynecologic Oncology Group. Cancer. 1981;48(4):899-903. doi:10.1002/1097-0142(19810815)48:4<899::aid-cncr2820480406>3.0.co;2-6
[4].Tomao F, Papa A, Rossi L, et al. Angiogenesis and antiangiogenic agents in cervical cancer. Onco Targets Ther. 2014;7:2237-2248. Published 2014 Dec 3. doi:10.2147/OTT.S68286
[5].Tewari KS, Sill MW, Long HJ 3rd, et al. Improved survival with bevacizumab in advanced cervical cancer [published correction appears in N Engl J Med. 2017 Aug 17;377(7):702. doi: 10.1056/NEJMx170002.]. N Engl J Med. 2014;370(8):734-743. doi:10.1056/NEJMoa1309748
[6].Abu-Rustum NR, Yashar CM, Arend R, et al. NCCN Guidelines® Insights: Cervical Cancer, Version 1.2024. J Natl Compr Canc Netw. 2023;21(12):1224-1233. doi:10.6004/jnccn.2023.0062
[7].Marabelle A, Le DT, Ascierto PA, et al. Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the Phase II KEYNOTE-158 Study. J Clin Oncol. 2020;38(1):1-10. doi:10.1200/JCO.19.02105
[8].O'Malley D M, Oaknin A, Monk B J, et al. LBA34 Single-agent anti-PD-1 balstilimab or in combination with anti-CTLA-4 zalifrelimab for recurrent/metastatic (R/M) cervical cancer (CC): Preliminary results of two independent phase II trials[J]. Annals of Oncology, 2020, 31: S1164-S1165. doi:10.1016/j.annonc.2020.08.2264
[9].Naumann R W, Oaknin A, Meyer T, et al. Efficacy and safety of nivolumab (Nivo)+ ipilimumab (Ipi) in patients (pts) with recurrent/metastatic (R/M) cervical cancer: Results from CheckMate 358[J]. Annals of Oncology, 2019, 30: v898-v899.
[10].Oaknin A, Backes F, Van Nieuwenhuysen E, et al. LIO-1: initial phase 2 experience of lucitanib+ nivolumab in patients with metastatic or recurrent cervical cancer (NCT04042116; ENGOT-GYN3/AGO/LIO)(034)[J]. Gynecologic Oncology, 2022, 166: S24.
[11].Friedman CF, Snyder Charen A, Zhou Q, et al. Phase II study of atezolizumab in combination with bevacizumab in patients with advanced cervical cancer. J Immunother Cancer. 2020;8(2):e001126. doi:10.1136/jitc-2020-001126
[12].Ferrara N. VEGF and the quest for tumour angiogenesis factors. Nat Rev Cancer. 2002;2(10):795-803. doi:10.1038/nrc909
[13].Greenblatt M, Shubi P. Tumor angiogenesis: transfilter diffusion studies in the hamster by the transparent chamber technique. J Natl Cancer Inst. 1968;41(1):111-124.
[14].Ehrmann RL, Knoth M. Choriocarcinoma. Transfilter stimulation of vasoproliferation in the hamster cheek pouch. Studied by light and electron microscopy. J Natl Cancer Inst. 1968;41(6):1329-1341.
[15].Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med. 1971;285(21):1182-1186. doi:10.1056/NEJM197111182852108
[16].Liu ZL, Chen HH, Zheng LL, Sun LP, Shi L. Angiogenic signaling pathways and anti-angiogenic therapy for cancer. Signal Transduct Target Ther. 2023;8(1):198. Published 2023 May 11. doi:10.1038/s41392-023-01460-1
[17].Ferrara N. VEGF and the quest for tumour angiogenesis factors. Nat Rev Cancer. 2002;2(10):795-803. doi:10.1038/nrc909
[18].Minion LE, Tewari KS. Cervical cancer - State of the science: From angiogenesis blockade to checkpoint inhibition. Gynecol Oncol. 2018;148(3):609-621. doi:10.1016/j.ygyno.2018.01.009
[19].Dang YZ, Zhang Y, Li JP, et al. High VEGFR1/2 expression levels are predictors of poor survival in patients with cervical cancer. Medicine (Baltimore). 2017;96(1):e5772. doi:10.1097/MD.0000000000005772
[20].Zhou A, Zhang W, Chang C, et al. Phase I study of the safety, pharmacokinetics and antitumor activity of famitinib. Cancer Chemother Pharmacol. 2013;72(5):1043-1053. doi:10.1007/s00280-013-2282-y
[21].Lindahl P, Johansson BR, Levéen P, Betsholtz C. Pericyte loss and microaneurysm formation in PDGF-B-deficient mice. Science. 1997;277(5323):242-245. doi:10.1126/science.277.5323.242
[22].Zou X, Tang XY, Qu ZY, et al. Targeting the PDGF/PDGFR signaling pathway for cancer therapy: A review. Int J Biol Macromol. 2022;202:539-557. doi:10.1016/j.ijbiomac.2022.01.113
[23].Taja-Chayeb L, Chavez-Blanco A, Martínez-Tlahuel J, et al. Expression of platelet derived growth factor family members and the potential role of imatinib mesylate for cervical cancer. Cancer Cell Int. 2006;6:22. Published 2006 Oct 2. doi:10.1186/1475-2867-6-22
[24].Roh HD, Boucher Y, Kalnicki S, Buchsbaum R, Bloomer WD, Jain RK. Interstitial hypertension in carcinoma of uterine cervix in patients: possible correlation with tumor oxygenation and radiation response. Cancer Res. 1991;51(24):6695-6698.
[25].Tsioumpekou M, Cunha SI, Ma H, et al. Specific targeting of PDGFRβ in the stroma inhibits growth and angiogenesis in tumors with high PDGF-BB expression [published correction appears in Theranostics. 2020 Jun 11;10(16):7406-7408. doi: 10.7150/thno.48039.]. Theranostics. 2020;10(3):1122-1135. Published 2020 Jan 1. doi:10.7150/thno.37851
[26].Hosaka K, Yang Y, Seki T, et al. Therapeutic paradigm of dual targeting VEGF and PDGF for effectively treating FGF-2 off-target tumors. Nat Commun. 2020;11(1):3704. Published 2020 Jul 24. doi:10.1038/s41467-020-17525-6
[27].Shan HJ, Jiang K, Zhao MZ, et al. SCF/c-Kit-activated signaling and angiogenesis require Gαi1 and Gαi3. Int J Biol Sci. 2023;19(6):1910-1924. Published 2023 Mar 27. doi:10.7150/ijbs.82855
[28].Taximaimaiti R, Abudujilile D, Maihemuti M, Abuliken X, Abudulimu H. Expression of AMHR2 and C-KIT in cervical lesions in Uyghur Women of Xinjiang, China. Medicine (Baltimore). 2018;97(22):e10793. doi:10.1097/MD.0000000000010793
[29].Lee WS, Yang H, Chon HJ, Kim C. Combination of anti-angiogenic therapy and immune checkpoint blockade normalizes vascular-immune crosstalk to potentiate cancer immunity. Exp Mol Med. 2020;52(9):1475-1485. doi:10.1038/s12276-020-00500-y
[30].https://clinicaltrials.gov/study/NCT04906993
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


