Molecular Cancer | 揭示RNA甲基化如何影响肿瘤免疫:从机制到治疗
来源:生物探索 2024-06-25 09:52
RNA甲基化在肿瘤免疫中的作用及其在免疫治疗中的潜力正逐渐被揭示。通过靶向RNA甲基化调控蛋白,有望开发出新的免疫治疗策略,提高癌症治疗的效果。
RNA甲基化是一种常见的转录后修饰,在研究领域中引起了广泛关注。它通过调节RNA剪接、翻译、运输和稳定性,对多种生物功能进行调控。值得注意的是,研究表明,RNA甲基化对肿瘤免疫具有显著影响。主要的RNA甲基化类型包括N6-甲基腺嘌呤(m6A)、5-甲基胞嘧啶(m5C)、N1-甲基腺嘌呤(m1A)、N7-甲基鸟嘌呤(m7G)和3-甲基胞嘧啶(m3C)。RNA甲基化参与了肿瘤微环境(TME)的调控。通过影响RNA翻译和稳定性,RNA甲基化通过“写入者”、“擦除者”和“读取者”调节免疫细胞和免疫因子的失调。因此,RNA甲基化在调节肿瘤免疫和介导多种生物行为(包括增殖、侵袭、转移等)中起着关键作用。
6月20日Molecular Cancer发表的综述“The role of RNA methylation in tumor immunity and its potential in immunotherapy”,讨论了几种RNA甲基化的机制和功能,全面概述了它们在肿瘤微环境和免疫细胞中的生物作用和基本机制。通过探讨这些RNA修饰如何介导肿瘤免疫逃逸,还分析了它们在免疫治疗中的潜在应用,为RNA甲基化新靶点的识别和提高癌症免疫治疗效果提供新的见解和策略。
RNA修饰通过对RNA碱基和核糖的化学变化,显著影响基因表达。到目前为止,研究人员已经在各种RNA类别(包括原核生物和真核生物)中鉴定出了超过170种化学修饰。其中,RNA甲基化占所有RNA修饰的60%以上,在转录后基因调控中起着重要作用。主要的RNA甲基化形式包括N1-甲基腺嘌呤(m1A)、N6-甲基腺嘌呤(m6A)、5-甲基胞嘧啶(m5C)、N7-甲基鸟嘌呤(m7G)和3-甲基胞嘧啶(m3C),这表明它在塑造基因调控的复杂景观中具有广泛存在和重要意义。RNA甲基化由三类蛋白质介导:“写入者”催化甲基基团的添加;“读取者”识别这些修饰;“擦除者”去除这些修饰,每种蛋白质通过独特的机制发挥作用。这些蛋白质调节多种RNA类型和信号通路,包括mRNA、tRNA、长链非编码RNA(lncRNA)、小RNA(sRNA)等。
作为一个动态且可逆的过程,RNA甲基化调节着关键的生物过程,如剪接、翻译、运输和RNA稳定性。大量研究表明,RNA甲基化在多种癌症的发生和进展中起着至关重要的作用,包括乳腺癌、肺癌、结直肠癌(CRC)、肝细胞癌(HCC)、胃癌(GC)、食道癌(EC)、前列腺癌(PCa)、膀胱癌、卵巢癌、急性髓性白血病(AML)、胰腺癌等,凸显了它在恶性肿瘤中的关键作用。
近年来,许多研究强调了RNA甲基化与各种免疫过程之间的密切关联,特别是在肿瘤免疫背景下。此外,调控蛋白的异常表达与致癌活动和增强的转移特性有关。RNA甲基化还在维持肿瘤微环境(TME)的稳态和代谢重编程中起着关键作用,影响免疫细胞的功能。TME由包括免疫细胞、基质细胞、细胞外基质、血管和其他可溶性因子在内的复杂多细胞基质组成。RNA甲基化通过影响癌基因和转移能力,破坏TME的和谐,损害免疫细胞功能,从而促进肿瘤免疫逃逸。例如,m6A写入者METTL3已知维持高水平的糖酵解,并在HCC中诱导代谢重编程。这种酶还影响巨噬细胞极化、树突状细胞的活化、效应T细胞的分化和增殖以及免疫检查点的表达。这些相互作用展示了RNA甲基化如何将TME和免疫细胞与肿瘤免疫逃逸的机制联系起来。目前,研究人员正在探索可能抑制METTL3和其他RNA甲基化调节因子的潜在抑制剂,希望这些化合物能用于免疫治疗。

RNA甲基化是一种常见的转录后修饰(post-transcriptional modification),在基因表达调控中扮演着关键角色。近年来,研究人员发现,RNA甲基化不仅在正常生理过程中重要,而且在肿瘤的发生和发展中也起到关键作用。尤其是它在调控肿瘤免疫和免疫逃逸方面的功能,引起了广泛关注。
RNA甲基化的类型与机制
目前已知的RNA甲基化类型超过170种,其中最主要的包括N6-甲基腺嘌呤(m6A)、5-甲基胞嘧啶(m5C)、N1-甲基腺嘌呤(m1A)、N7-甲基鸟嘌呤(m7G)和3-甲基胞嘧啶(m3C)。这些修饰通过特定的蛋白质进行调控:
写入者(Writers):如METTL3和METTL14等,催化甲基基团的添加。
擦除者(Erasers):如FTO和ALKBH5等,去除甲基基团。
读取者(Readors):如YTHDF1和IGF2BP1等,识别并结合甲基化修饰,调控RNA的功能。
其中,m6A是最常见的RNA甲基化形式,广泛存在于mRNA、rRNA、tRNA、长链非编码RNA(lncRNA)和小RNA(sRNA)中。m6A甲基化调控着RNA的剪接、翻译、稳定性和运输等关键生物过程。
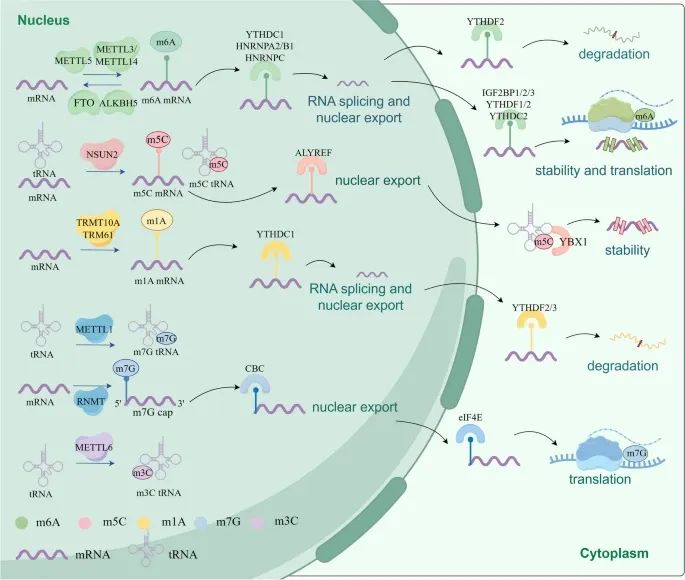
RNA甲基化的机制以及RNA甲基化如何调控RNA的命运和生物功能(Credit: Molecular Cancer)
RNA甲基化的写入者(Writers):m6A:METTL3和METTL14;m5C:NSUN2;m1A: TRMT10A;m7G:METTL1。
RNA甲基化的擦除者(Erasers):m6A:FTO和ALKBH5。
RNA甲基化的读取者(Readors):IGF2BP1/2/3、YTHDF1/2/3、YTHDC1/2/3、YBX1、ALYREF、CBC、eIF4E等蛋白质可以识别并结合RNA上的甲基化修饰。
RNA甲基化对RNA命运的调控:RNA甲基化可以调控mRNA的剪接、导出、稳定性、降解和翻译等生物功能。
关键蛋白:METTL3 (methyltransferase-like 3),FTO (obesity-associated protein),ALKBH5 (AlkB homolog 5),TET1/2/3 (ten-eleven translocation proteins 1/2/3),ALKBH1 (α-ketoglutarate-dependent dioxygenase ABH1)
RNA甲基化在肿瘤中的作用
大量研究表明,RNA甲基化在多种癌症的发生和进展中起着至关重要的作用。例如,m6A写入者METTL3在肝细胞癌(HCC)中维持高水平的糖酵解,并诱导代谢重编程。这种酶还影响巨噬细胞的极化、树突状细胞的活化、效应T细胞的分化和增殖以及免疫检查点的表达。
METTL3在HCC中的作用:研究表明,METTL3通过上调葡萄糖转运蛋白(GLUT1)的表达,促进糖酵解进程,从而为肿瘤细胞的增殖提供必要的能量条件。此外,METTL3还通过调控HIF-1α的表达,促进缺氧条件下肿瘤细胞的存活和增殖。
NSUN2在食道癌中的作用:NSUN2通过稳定GRB2的表达,增强癌细胞的增殖和迁移能力。另有研究表明,NSUN2能够通过调控CDKN1A的表达,抑制脂肪生成,表明NSUN2在肿瘤代谢重编程中也起到重要作用。
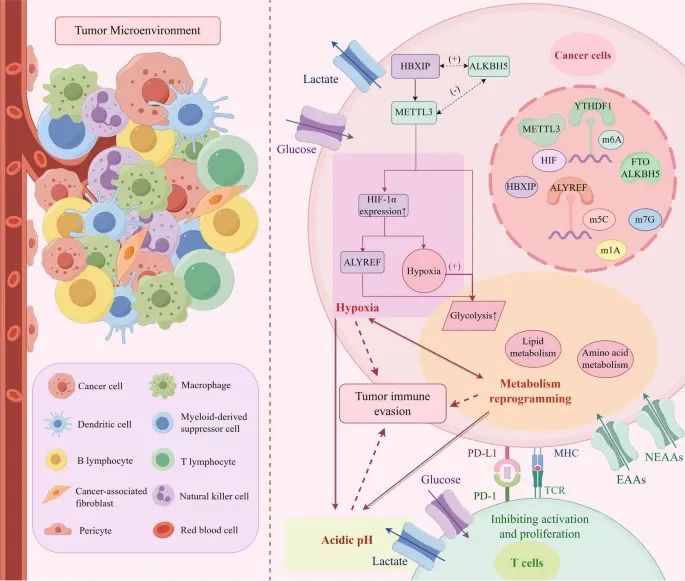
肿瘤微环境(TME)的组成以及RNA甲基化如何通过缺氧、代谢重编程和酸性环境来促进肿瘤免疫逃逸(Credit: Molecular Cancer)
肿瘤微环境的组成:肿瘤微环境包括免疫细胞、基质细胞、细胞外基质、血管和其他可溶性因子。
RNA甲基化在肿瘤免疫逃逸中的作用:缺氧诱导因子(HIF)通过m6A、m5C、m1A和m7G RNA甲基化来调控免疫抑制性TME的形成,并促进肿瘤免疫逃逸。RNA甲基化调控生物代谢,包括葡萄糖代谢、脂质代谢和氨基酸代谢,导致免疫细胞功能障碍和酸性环境的形成,从而促进肿瘤发生、血管生成和肿瘤细胞增殖。这些变化进一步加重组织缺氧,促进肿瘤进展。
代谢重编程与肿瘤进展:葡萄糖代谢:通过m6A、m5C、m1A和m7G RNA甲基化调控葡萄糖代谢途径,促进肿瘤细胞的糖酵解;脂质代谢:RNA甲基化调控脂质代谢,影响脂肪酸的合成、降解和储存,促进肿瘤细胞的膜结构和能量生成;氨基酸代谢:RNA甲基化调控非必需氨基酸(NEAAs)和必需氨基酸(EAAs)的代谢,影响肿瘤细胞的生长和免疫逃逸。
相互作用与协同作用:缺氧、代谢重编程和酸性环境相互作用,共同促进肿瘤免疫逃逸;缺氧环境激活HIF,进一步调控RNA甲基化,促进肿瘤进展;代谢重编程导致酸性环境的形成,影响免疫细胞功能,加剧肿瘤免疫逃逸。
RNA甲基化与肿瘤免疫
RNA甲基化在肿瘤免疫调控中发挥着重要作用。它通过影响肿瘤微环境(TME)中的免疫细胞和免疫因子的失调,调节肿瘤免疫逃逸机制。主要机制包括:
调控免疫细胞功能:RNA甲基化通过调控免疫细胞如巨噬细胞、树突状细胞(DCs)、髓源性抑制细胞(MDSCs)和调节性T细胞(Tregs)的功能,影响肿瘤免疫逃逸。例如,m6A写入者METTL3促进巨噬细胞的M1极化,增强其抗肿瘤能力,而FTO则通过抑制NF-κB信号通路,抑制M1和M2巨噬细胞的极化。
调控TME稳态:RNA甲基化通过调控糖酵解、脂肪代谢和氨基酸代谢,影响TME的代谢重编程,进而影响肿瘤免疫。例如,METTL3通过上调GLUT1的表达,促进糖酵解进程,为肿瘤细胞的增殖提供条件。
调控免疫检查点:RNA甲基化通过调控免疫检查点如PD-1/PD-L1的表达,影响肿瘤免疫逃逸。研究表明,m6A读取者YTHDF1在DCs中上调MHC-II的表达,增强抗原呈递能力,从而增强免疫反应。
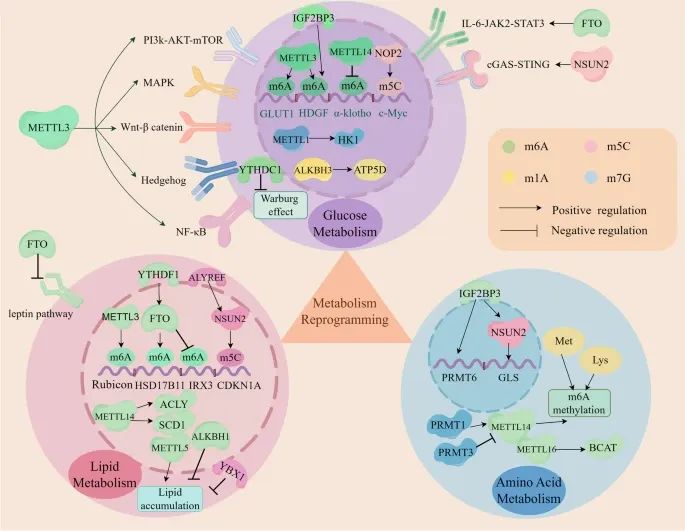
RNA甲基化如何参与肿瘤微环境(TME)的代谢重编程,包括葡萄糖代谢、脂质代谢和氨基酸代谢(Credit: Molecular Cancer)
RNA甲基化在代谢重编程中的作用:RNA甲基化调控与糖酵解相关基因(如GLUT1、Gys2、HDGF)和信号通路(如PI3K-AKT、mTORC1、MAPK、Wnt-β catenin、Hedgehog、NF-κB、IL-6/JAK2/STAT3、cGAS/STING)的表达,通过这些调节因子(如METTL1、METTL3、METTL14、NOP2、NSUN2、FTO、ALKBH3、IGF2BP3、YTHDC1)增强Warburg效应。
葡萄糖代谢:m6A、m5C和m7G甲基化通过调控糖酵解相关基因和信号通路,促进葡萄糖代谢。例如,METTL3通过上调GLUT1的表达,增强糖酵解进程。
脂质代谢:m6A和m5C甲基化加速脂质积累。具体而言,m6A和m5C甲基化调控脂质代谢相关基因(如ACLY和SCD1)的表达,促进脂肪酸的合成和储存。
氨基酸代谢:m6A、m5C和m7G甲基化调控谷氨酰胺、精氨酸、蛋氨酸和赖氨酸的代谢。例如,BCAT1(支链氨基酸转氨酶1)在AML中通过重编程BCAA代谢促进癌症发生。
代谢重编程的影响:这些甲基化修饰影响肿瘤细胞的免疫原性、增殖、免疫逃逸以及肿瘤进展。例如,m6A读取者IGF2BP3通过稳定PRMT1 mRNA,调控蛋白精氨酸甲基转移酶1(PRMT1)的表达,从而影响肿瘤细胞的功能。
YTHDF1在DCs中的作用:通过敲除YTHDF1基因,研究人员发现DCs中的MHC-II表达显著增加,IL-12的分泌也有所增强,从而提升了适应性免疫反应。
METTL3在MDSCs中的作用:研究发现,敲除METTL3基因能够显著减少MDSCs的积累,从而增强CD8+ T细胞的活化和增殖。
FTO在肿瘤中的作用:FTO抑制剂能够通过抑制肿瘤细胞的糖酵解进程,逆转CD8+ T细胞的活化和效应状态。结合FTO抑制剂和抗PD-L1治疗,有望显著提高抗肿瘤免疫反应。
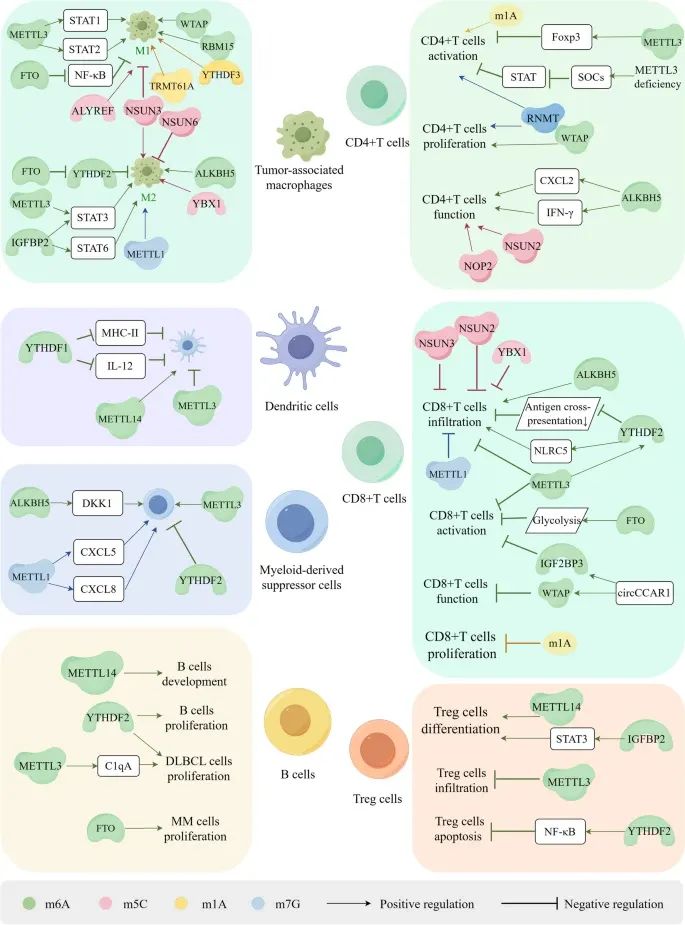
RNA甲基化如何在肿瘤微环境(TME)中调控免疫细胞的生物功能,包括免疫细胞的分化、发育、浸润、活化、增殖和凋亡(Credit: Molecular Cancer)
免疫细胞的分化和发育:RNA甲基化在免疫细胞的分化和发育中起重要作用。例如,m6A和m5C甲基化调控CD8+ T细胞的浸润和活化,并介导其功能障碍。
肿瘤相关巨噬细胞(TAMs)的极化:RNA甲基化促进肿瘤相关巨噬细胞(TAMs)向M1型或M2型巨噬细胞的极化;TAMs的M1型巨噬细胞具有抗肿瘤作用,而M2型巨噬细胞则具有促肿瘤作用。
树突状细胞(DCs)、髓源性抑制细胞(MDSCs)和调节性T细胞(Tregs)的增殖和浸润:RNA甲基化调控树突状细胞(DCs)、髓源性抑制细胞(MDSCs)和调节性T细胞(Tregs)的增殖和浸润。例如,m6A甲基化通过调控DCs的抗原呈递能力,影响免疫反应。
T细胞的分化和发育:RNA甲基化在T细胞的分化和发育中起重要作用。m1A和m7G甲基化参与CD4+ T细胞和CD8+ T细胞的活化、浸润和增殖,但这些过程中m1A和m7G的具体调控机制尚需进一步研究。
RNA甲基化在肿瘤免疫反应和逃逸中的作用:RNA甲基化通过影响免疫细胞的分化、发育、浸润、活化、增殖和凋亡,调控肿瘤免疫反应和逃逸。例如,m6A和m5C甲基化通过抑制CD8+ T细胞的浸润和活化,介导其功能障碍,从而促进肿瘤免疫逃逸。
RNA甲基化在免疫治疗中的潜力
随着对RNA甲基化在肿瘤免疫调控中作用的深入研究,研究人员开始探索其在免疫治疗中的应用潜力。通过靶向RNA甲基化调控蛋白,有望开发出新的免疫治疗策略,提高癌症治疗的效果。
靶向METTL3:研究发现,抑制METTL3的表达能够显著减少MDSCs的积累,从而增强CD8+ T细胞的活化和增殖。靶向METTL3的抑制剂有望成为一种新的免疫治疗手段。
靶向FTO:FTO作为一种去甲基酶,其抑制剂已被证明能够通过抑制肿瘤细胞的糖酵解进程,逆转CD8+ T细胞的活化和效应状态。结合FTO抑制剂和抗PD-L1治疗,有望显著提高抗肿瘤免疫反应。
靶向YTHDF1:抑制YTHDF1的表达能够增强树突状细胞的抗原呈递能力,从而增强免疫反应。研究表明,YTHDF1抑制剂有望提高癌症患者对免疫治疗的响应率。
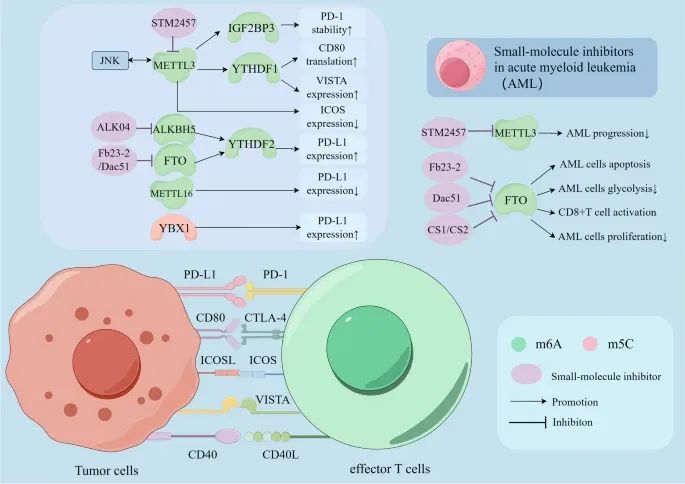
RNA甲基化如何通过其调控因子调节免疫检查点的表达,并且在急性髓性白血病(AML)中,几种小分子抑制剂联合免疫检查点阻断疗法的应用(Credit: Molecular Cancer)
共抑制性受体-配体复合物:包括PD-1/PD-L1、CTLA-4/CD80、VISTA等。这些复合物通过与肿瘤细胞上的相应配体结合,向T细胞传递负性信号,从而抑制T细胞的抗肿瘤反应。
共刺激性受体-配体复合物:包括CD40/CD40L、ICOS/ICOSL等。这些复合物通过与肿瘤细胞上的相应配体结合,向T细胞传递正性信号,从而增强T细胞的抗肿瘤反应。
RNA甲基化调控免疫检查点的机制:m6A和m5C甲基化通过调控免疫检查点的表达、翻译和稳定性,影响其对免疫治疗的敏感性。例如,免疫检查点PD-1、CTLA-4、ICOS、VISTA和CD40L通过与肿瘤细胞上的相应配体结合,触发T细胞反应的负性或正性信号。
RNA甲基化的调控因子:参与调控免疫检查点的RNA甲基化调控因子包括METTL3、ALKBH5、FTO和METTL16等。这些调控因子通过调节m6A和m5C甲基化,影响免疫检查点的功能。
小分子抑制剂的应用:针对METTL3和FTO的几种小分子抑制剂,包括STM2457、Alk-04、FB23-2和Dac51等,可以抑制m6A甲基化过程,并应用于AML的治疗。这些小分子抑制剂联合免疫检查点阻断疗法,有望提高AML患者的治疗效果。
RNA甲基化在肿瘤免疫中的作用及其在免疫治疗中的潜力正逐渐被揭示。通过靶向RNA甲基化调控蛋白,有望开发出新的免疫治疗策略,提高癌症治疗的效果。未来的研究需要进一步探索RNA甲基化在肿瘤免疫中的具体机制,并开发更多的RNA甲基化调控剂,以期在临床上取得突破。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


