J Extracell Vesicles: 缺氧时促血管生成细胞外囊泡的分泌依赖于自噬相关蛋白Gabarapl
来源:本站原创 2021-12-14 13:38
肿瘤缺氧是实体肿瘤的一个标志,与肿瘤进展、转移发展和治疗抵抗有关。作为对缺氧的反应,肿瘤细胞分泌促血管生成因子,诱导血管形成,恢复缺氧区域的氧气供应。细胞外小泡(EVS)是肿瘤微环境中细胞间通讯的媒介
肿瘤缺氧是实体肿瘤的一个标志,与肿瘤进展、转移发展和治疗抵抗有关。作为对缺氧的反应,肿瘤细胞分泌促血管生成因子,诱导血管形成,恢复缺氧区域的氧气供应。细胞外小泡(EVS)是肿瘤微环境中细胞间通讯的媒介。在这里,作者证明了LC3/GABARAP蛋白家族成员GABARAPL1的表达增加是内体成熟、分选到内体和肠病毒分泌所必需的。
图片来源: https://doi.org/10.1002/jev2.12166
GABARAPL1是GABARAP蛋白家族的成员,GABARAP蛋白家族是一组蛋白质,通过介导重要的细胞过程,如自噬和受体向质膜的运输,促进细胞内环境的稳定。作为LC3/GABARAP蛋白家族的成员,GABARAPL1被认为在自噬的一般执行过程中发挥作用。作者意外地观察到GABARAPL1对于(宏)自噬的一般执行不是必需的。
顺理成章的是,最近的研究表明GABARAPL1可能更多地参与了选择性形式的自噬。然而,GABARAP蛋白在执行自噬过程中的功能冗余已经被描述,并可能解释为什么沉默GABARAPL1对自噬活性的影响可以忽略不计。
在这项研究中,作者描述了GABARAPL1在缺氧时需要分泌EVS和生长因子,从而促进了不同类型肿瘤细胞的生长。此外,作者还证明了GABARAPL1和GABARAP在较小范围内的表达,而不是GABARAPL2的表达,强调了不同的GABARAP家族成员的独特功能。
除了缺氧,其他胁迫也诱导GABARAPL1的表达,这表明GABRAPL1被细胞作为一种一般的应激反应机制,或者作为一种缓解应激的机制。虽然我们只在体外实验中使用了严重缺氧,但这并不排除其他应激源或外部因素也能引起类似的影响。
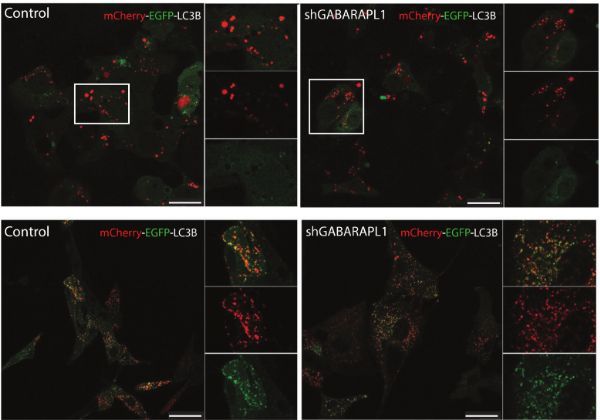
EVS,更具体地说是外泌体,是在内体成熟过程中通过限制的内胚体膜向内萌发而形成的。早到晚的内容体的成熟是由内化的囊泡和反式高尔基体产生的货物被分拣到内切体途径的结果。本研究数据显示,沉默GABARAPL1导致早期内小体增大和RAB7活性降低,提示内小体途径功能受损,可能是由于内小体中分拣的货物减少所致。同样,GABARAPL1缺陷细胞可能通过抑制内体成熟,将较少的蛋白质货物分拣到相同数量的分泌型EV中。
不同的细胞系在分泌EVS的水平上有显著的差异。GABARAPL1基因缺陷的HT29细胞分泌的EVS显著减少。相反,沉默U87细胞中的GABARAPL1仅导致EV成分的改变。更具体地说,在分泌型EV中,EV标志物CD9和CD81降低,而CD63表达显著稳定。有趣的是,U87细胞似乎具有GABARAPL1阴性,但CD63阳性的胞浆结构。这表明,与HT29相比,U87具有独立于GABARAPL1的额外的排序和分泌机制。
此外,如前所述,GABARAPL1也是缺氧诱导的EGFR和其他缺氧相关因子的膜表达所必需的。为了测试这一点,GABARAPL1基因敲除肿瘤及其直接环境应该成为GABARAPL1+EVS的靶点。在体内直接注射分离的GABARAPL1+EVS有几个缺点,如EV用量、生物分布和生物利用度。此外,EV分离可能会改变其在体内的行为。
MCherry-EGFP-LC3B表达细胞的共聚焦显微镜观察
图片来源: https://doi.org/10.1002/jev2.12166
在这份报告中,作者描述了一个独特的EV亚集的发现,它由低氧细胞特异性分泌,并依赖于低氧诱导的GABARAPL1表达。重要的是,本研究观察到GABARAPL1在分泌后表达于这些EV的表面。通过使用GABARAPL1的封闭抗体来利用这一治疗切入点,这导致了体外EV功能的抑制。
此外,研究还发现,在肿瘤异种移植中沉默GABARAPL1后,肿瘤生长和再生长在照射后延迟,这是由于血管化减少和肿瘤坏死增加所致。总之,本研究显示了GABARAPL1通过低氧细胞分泌EVS在肿瘤进展中的独特作用。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。