肿瘤治疗新手段:诱导焦亡和铁死亡,促进抗肿瘤免疫
来源:生物探索 2023-09-19 14:11
近期,唐本忠院士、林荣业教授和武汉大学孙志军教授、邓鹤翔教授团队合作,发现乙烯基连接的AIE COF可以成功诱导焦亡(J. Am. Chem. Soc. 2023, 145, 32, 17689-17
近期,唐本忠院士、林荣业教授和武汉大学孙志军教授、邓鹤翔教授团队合作,发现乙烯基连接的AIE COF可以成功诱导焦亡(J. Am. Chem. Soc. 2023, 145, 32, 17689-17699)。那么能否进一步研发出具有同时诱导焦亡和铁死亡的双功能AIE COF诱导剂呢?

有鉴于此,武汉大学孙志军教授/邓鹤翔教授和香港科技大学唐本忠教授/林荣业教授合作,通过在COF骨架中引入两种平面和扭曲构象的AIE分子,成功获得了一种能同时诱导焦亡和铁死亡的双功能诱导剂:COF-919。这种AIE COF相对于现有的COF光敏剂具有以下几个优点:1. 具有更好的近红外(NIR)光吸收、更低的能带能量和更长的寿命,有利于诱导焦亡。2. 其优异的ROS产生能力可进一步消耗还原性谷胱甘肽,使得谷胱甘肽过氧化物酶4(GPX4)表达低,进而诱导GPX4依赖的铁死亡过程。3. COF-919的光热治疗(PTT)性能也可进一步增强焦亡和铁死亡过程。4. AIE COFs的高孔隙度不仅可以有效避免ACQ效应,还有助于ROS扩散过程。这些优势使COF-919可以作为一种高效的焦亡和铁死亡双功能诱导剂。
分子机制研究表明:COF-919介导的光疗可以促进GSDME依赖的焦亡和GPX4依赖的铁死亡。另一方面,COF-919介导的光疗能促进T细胞的浸润,降低髓源性抑制细胞(MDSCs)的比例。当与αPD-1联合应用时,在抑制肿瘤转移和复发方面表现出优异的协同效应,能有效消除原发肿瘤并抑制远端肿瘤的生长,并大幅延长小鼠生存期。这项工作不仅拓展了AIE COFs的生物医学应用,而且提供了一种新的焦亡和铁死亡双功能诱导剂设计思路,为增强癌症免疫治疗疗效提供了新的策略及研究基础。
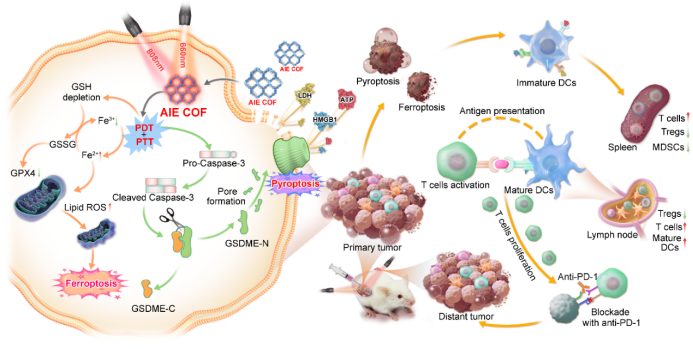
图1. 聚集诱导发光共价有机框架(AIE COF)基焦亡和铁死亡双功能诱导剂的设计策略。
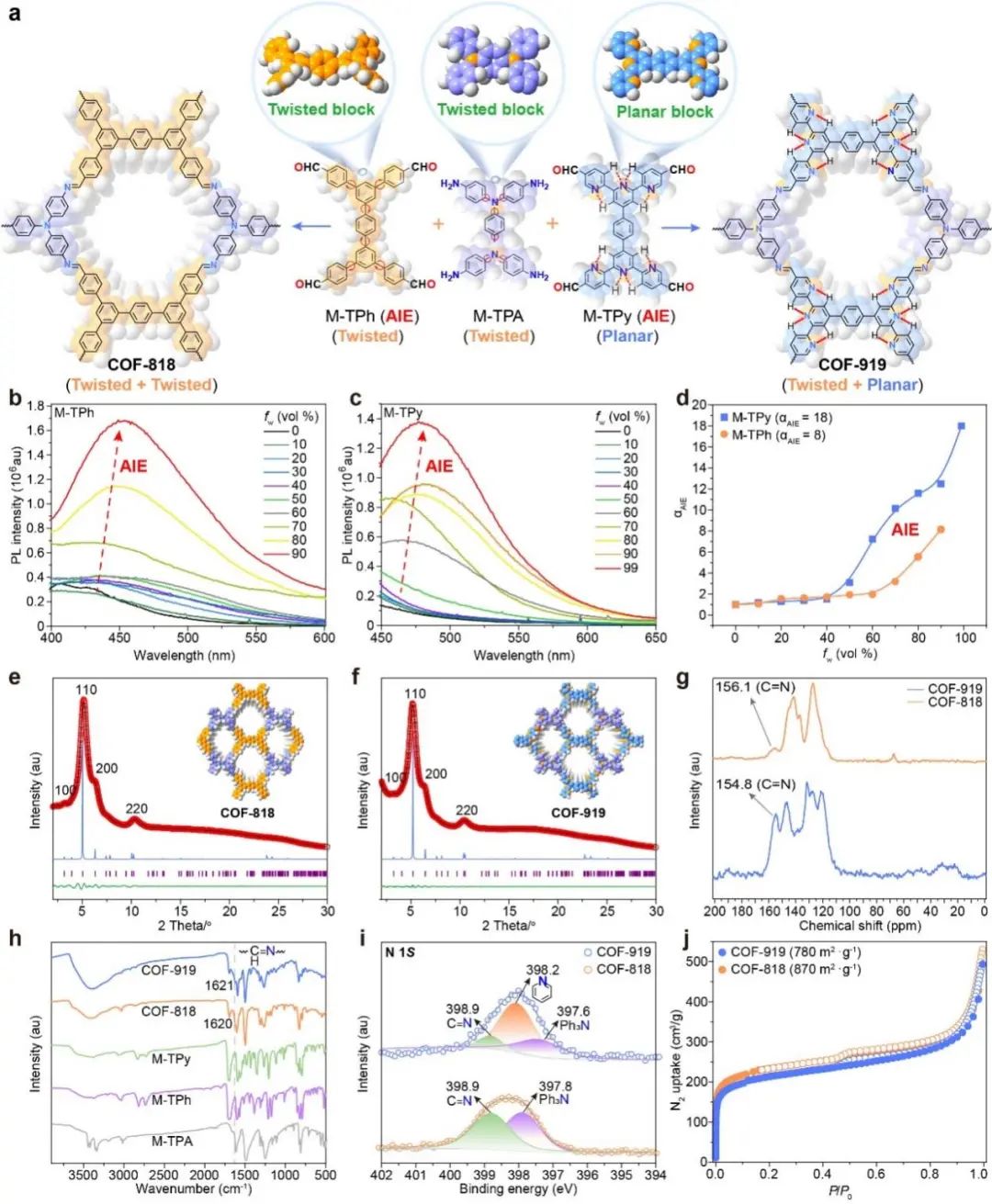
图2. AIE COF(COF-818和COF-919)的构建及结构表征。
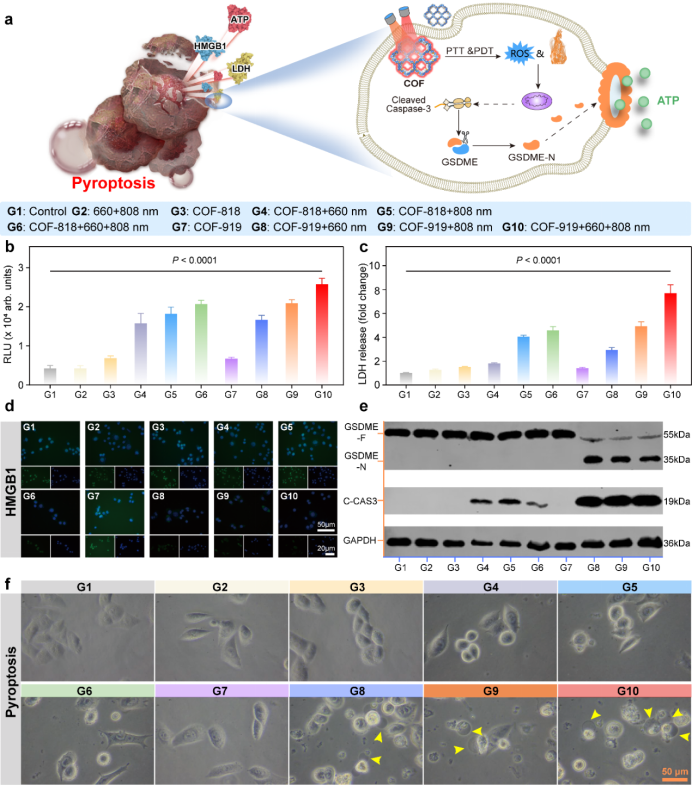
图3. AIE COF(COF-818和COF-919)诱导焦亡的能力。
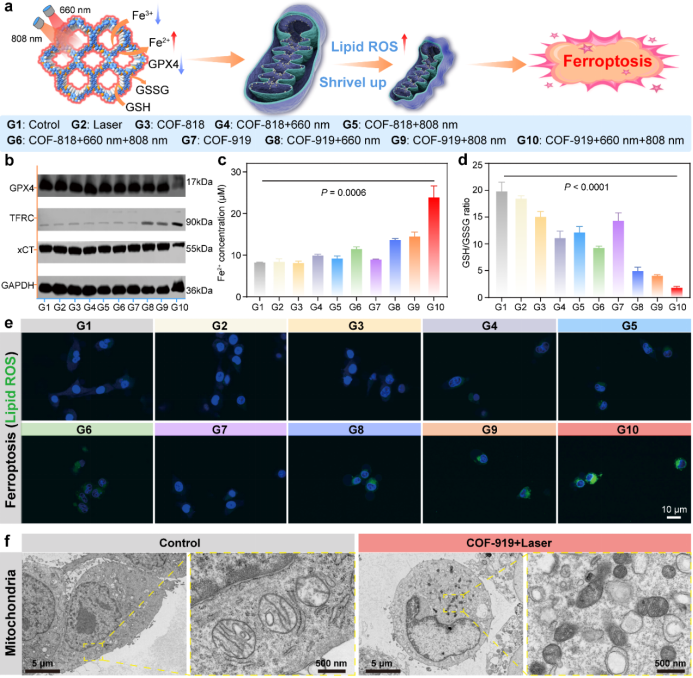
图4. AIE COF(COF-818和COF-919)诱导铁死亡的能力。
该研究成果近日以论文形式在线发表在Nature Communications 上,题目为“Integration of AIEgens into Covalent Organic Frameworks for Pyroptosis and Ferroptosis Primed Cancer Immunotherapy”。香港科技大学博士后张亮和武汉大学口腔医院博士研究生宋安为该论文共同第一作者,武汉大学孙志军、邓鹤翔、香港中文大学(深圳)唐本忠院士、林荣业教授为该论文共同通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


