Nat Cell Biol:守护胰岛素的液态车间:PDIA6相分离驱动胰岛素前体高效折叠
来源:BioArt 2025-12-03 15:34
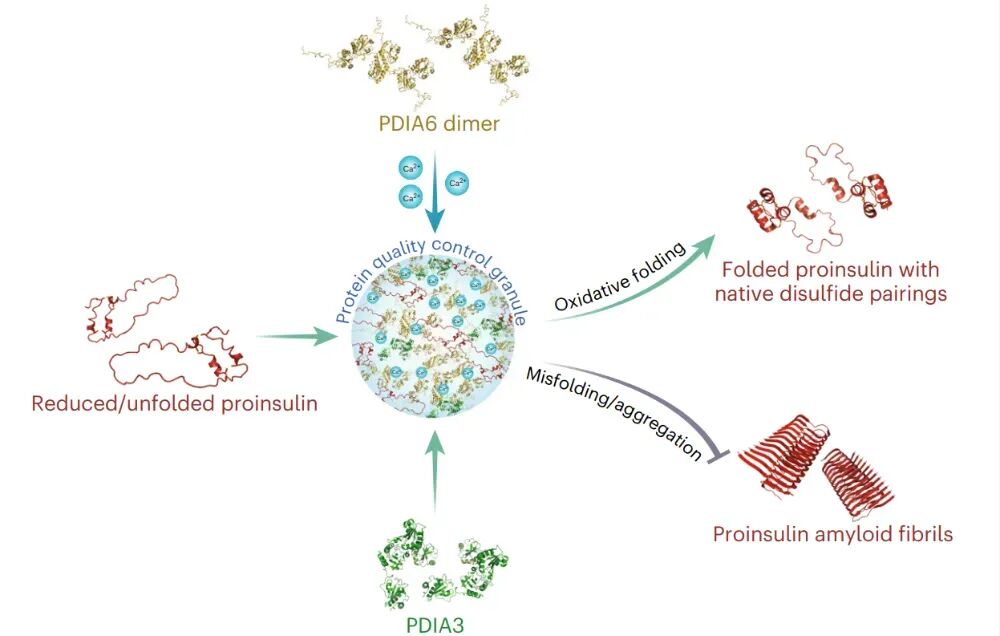
内质网钙离子波动通过驱动PDIA6发生相分离,形成一个既能加速正确折叠又能有效防止错误折叠的“活性反应中心”,这是细胞确保胰岛素等重要蛋白质实现高效、高质量生产的一种精密调控策略。
内质网作为真核细胞中负责蛋白质合成、折叠与质量监控的核心细胞器,其内部环境的稳态,特别是钙离子浓度的动态平衡,对于维持其功能至关重要。内质网中存在着一个由分子伴侣和氧化还原酶等构成的复杂蛋白质稳态网络,以确保大量新合成蛋白质能够正确折叠。
然而,这个网络如何响应并利用内质网中关键的第二信使——钙离子的波动来精确调控蛋白质折叠质量,仍是一个未被完全阐明的重要科学问题。蛋白质二硫键异构酶家族成员是这一网络中的核心执行者,它们不仅能够结合钙离子,还能形成可逆的寡聚体以调节自身功能。近年来,生物分子缩合物的形成(一种通过液-液相分离形成无膜细胞器的过程)被发现在细胞区室化调控中扮演关键角色。
近日,日本东北大学Masaki Okumura、Young-Ho Lee和Tomohide Saio联合在Nature Cell Biology期刊上发表题为Ca2+-driven PDIA6 biomolecular condensation ensures proinsulin folding的研究论文,揭示了内质网钙离子通过触发蛋白质二硫键异构酶PDIA6发生独特的相分离,形成一种既能加速胰岛素前体正确折叠、又能抑制其错误聚集的“质量控制颗粒”,从而确保胰岛素的有效分泌。

研究团队发现内质网腔内的钙离子是PDIA6发生液-液相分离的特异性触发因子。在接近于生理浓度的钙离子(>2.5 mM)和偏酸性pH环境下,PDIA6能够形成动态的、可逆的液体样缩合物,这一点通过荧光漂白恢复实验中快速的荧光恢复(半衰期约19秒)得到了证实。其分子机制极具特色,它不同于常见的由固有无序区域驱动的相分离,而是由PDIA6自身已折叠的结构域之间的特异性相互作用所介导。
然后,通过精巧的域组合实验和核磁共振分析,精确地鉴定出该过程依赖于两个关键的结构要素:其一,是N末端a0结构域的二聚化能力,这为形成多价相互作用提供了基础;其二,是a0结构域与C末端b结构域之间瞬时、特异的静电相互作用。这种由折叠结构域介导的多价结合,构成了PDIA6相分离的分子基础。
进一步地,本研究揭示了这种缩合物在细胞内确实存在且功能重要。当使用药物短暂耗尽内质网钙离子后再恢复时,可以在细胞(U2OS)中观察到内源性的PDIA6形成点状焦点结构,这些结构与内质网标记物共定位,并且同样具有液体的动态特性,表明体外发现的相分离现象在活细胞中具有生理相关性。
更重要的是,PDIA6缩合物并非一个封闭的系统,它能够选择性招募其他蛋白质二硫键异构酶家族成员,例如PDIA3,共同构成一个功能复合体,同时它更会主动招募其关键的客户蛋白——胰岛素前体。
最后,本研究阐明了这种相分离行为的功能意义。PDIA6形成的缩合物并非被动的聚集,而是一个功能高度活跃的“质量控制颗粒”。本研究通过体外折叠动力学实验证明,与处于分散状态的PDIA6相比,浓缩在缩合物内的PDIA6其催化胰岛素前体进行氧化折叠(形成正确二硫键)的效率提升了约三倍,这可能是由于缩合物极大地提高了局部的反应物浓度和效率。另一方面,该缩合物展现出强大的分子伴侣活性,能有效将容易错误折叠的胰岛素前体“隔离”开来,显著抑制其发生聚集和形成淀粉样纤维,起到了“隔离罩”的作用。
细胞功能实验为此提供了有力的支持:在PDIA6基因敲除细胞中回补一个丧失二聚化和相分离能力的PDIA6突变体(A5)时,它虽然仍具有一定的催化活性,但无法完全恢复胰岛素的正常分泌,并且会导致更多胰岛素前体形成不溶性的聚集物。这直接证明了PDIA6的相分离能力是其在内质网中行使高效质量控制功能所必需的。
综上所述,该研究描绘了一幅新颖的图景:内质网钙离子波动通过驱动PDIA6发生相分离,形成一个既能加速正确折叠又能有效防止错误折叠的“活性反应中心”,这是细胞确保胰岛素等重要蛋白质实现高效、高质量生产的一种精密调控策略。
原文链接:
https://doi.org/10.1038/s41556-025-01794-8
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


