《自然》:颠覆认知!PARP抑制剂杀死癌细胞的机制,我们搞错了
来源:奇点糕 2024-07-23 12:17
结果表明,PARP抑制剂是通过抑制PARP1的活性诱发转录-复制冲突,进而导致DNA损伤,而与PARPs的被捕获无关,因为敲除PARP之后,它们就无法被DNA捕获,也就不可能由此导致复制叉受损。
前不久,由瑞士日内瓦大学Thanos D. Halazonetis领衔的研究团队,在《自然》杂志上发表的研究论文表明:PARP抑制剂发挥“合成致死”作用的机制,我们理解错了[1]。
Halazonetis团队发现,在同源重组缺陷的癌细胞中,PARP抑制剂杀死癌细胞的方式是制造转录-复制冲突(TRCs),导致DNA双链断裂;而不是PARP被困在DNA上造成的复制叉受损。
这一发现让我们对PARP抑制剂的“合成致死”作用有了全新的认知,也有助于研究人员进一步改良PARP抑制剂的疗效和副作用。

▲ 论文首页截图
PARP的中文全称是多腺苷二磷酸核糖聚合酶,它发现于60年前[4]。
目前认为,PARP家族有17个成员,其中PARP1和PARP2是唯二具有DNA修复和多聚ADP-核糖基化(PAR化,有助于从DNA上脱落)功能的成员。
作为一种DNA损伤后修复相关蛋白,PARPs在识别到DNA上的单链断裂缺口后,会与DNA结合并激活PARPs的催化活性;随后烟酰胺腺嘌呤二核苷酸(NAD+)会与PARPs的活性位点结合,并招募DNA修复蛋白修复受损DNA。
之前的研究认为,PARP抑制剂作用于PARPs之后,会抑制PARPs的催化活性,导致PARPs不能完成PAR化并脱离DNA(被“捕获”),进而造成复制叉受损并出现致死性双链断裂。
作为癌症DNA复制应激领域的专家,Thanos D. Halazonetis注意到一个异常现象:有些研究发现PARP抑制剂对PARPs的抑制能力,与对PARPs的捕获能力的相关性很差。从理论上讲,PARP抑制剂的抑制活性越强,导致PARPs被捕获的能力肯定也越强。
如果二者之间不匹配,说明“合成致死”的背后,肯定还有我们不知道的东西。Halazonetis团队敏锐地抓住了这个问题,并从他们熟悉的转录-复制冲突(TRCs)入手,因为转录-复制冲突也会导致DNA双链断裂,而DNA损伤修复过程中,完全有可能出现这个问题。
Halazonetis团队在查阅相关资料之后发现,PARP1会与一个名为TIMELESS的蛋白相互作用,而TIMELESS和TIPIN极有是可能是哺乳动物细胞保护复制体免遭转录破坏的重要蛋白,因为TIMELESS和TIPIN的近亲Tof1和Csm3在酵母中就发挥这样的作用。
于是他们先在人宫颈癌细胞中证实了TIMELESS和TIPIN抑制转录-复制冲突的作用。如此一来,PARP1极有可能与转录-复制冲突(TRCs)扯上关系。
他们测试了奥拉帕利、talazoparib、veliparib和saruparib,发现这四种PARP抑制剂都会诱发DNA损伤反应,而转录延伸抑制剂(DRB等)会抑制这种反应。简单来说,如果用抑制转录的药物处理癌细胞的话,PARP抑制剂的作用就消失了。这进一步说明,PARP抑制剂导致DNA损伤就是借助于转录-复制冲突(TRCs)。
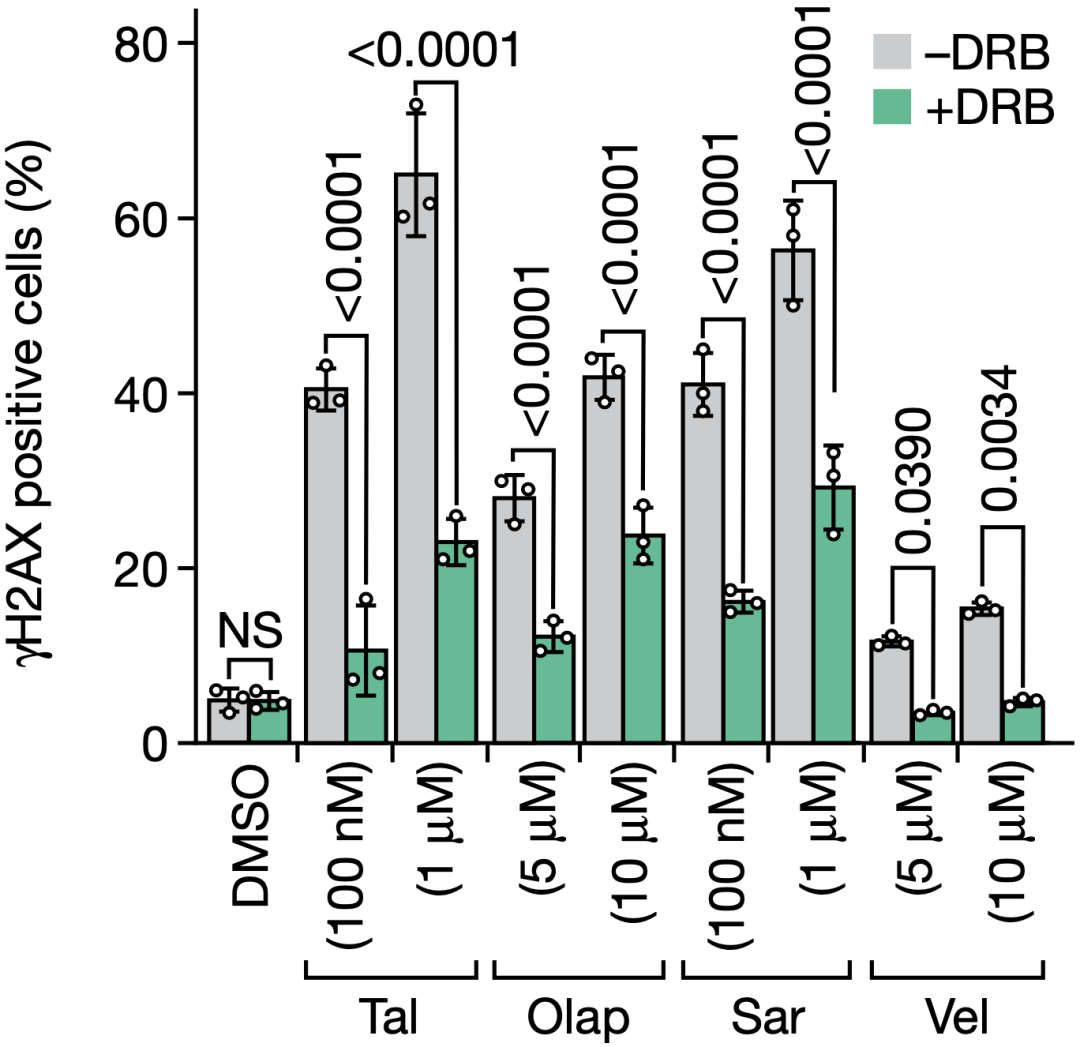
▲ 抑制转录-复制冲突(TRCs),就抑制了PARP抑制剂带来的DNA损伤
随后,Halazonetis团队又做了一系列实验,证实PARP抑制剂确实会导致转录-复制冲突(TRCs)。
接下来的问题是,PARP抑制剂是不是通过促进PARPs的捕获导致了转录-复制冲突呢?
于是,他们探索了PARP抑制剂的活性、PARPs的捕获水平,以及转录-复制冲突依赖性DNA损伤反应水平,三者之间的关系。他们发现,PARP抑制剂的活性与PARPs的捕获水平并不十分相关,而是与转录-复制冲突依赖性DNA损伤反应水平密切相关。
基于PARP1和PARP2敲除的研究还发现,敲除PARP1以依赖转录伸长的方式诱导了DNA损伤反应,而敲除PARP2则没有这种影响。这些结果表明,PARP抑制剂是通过抑制PARP1的活性诱发转录-复制冲突,进而导致DNA损伤,而与PARPs的被捕获无关,因为敲除PARP之后,它们就无法被DNA捕获,也就不可能由此导致复制叉受损。
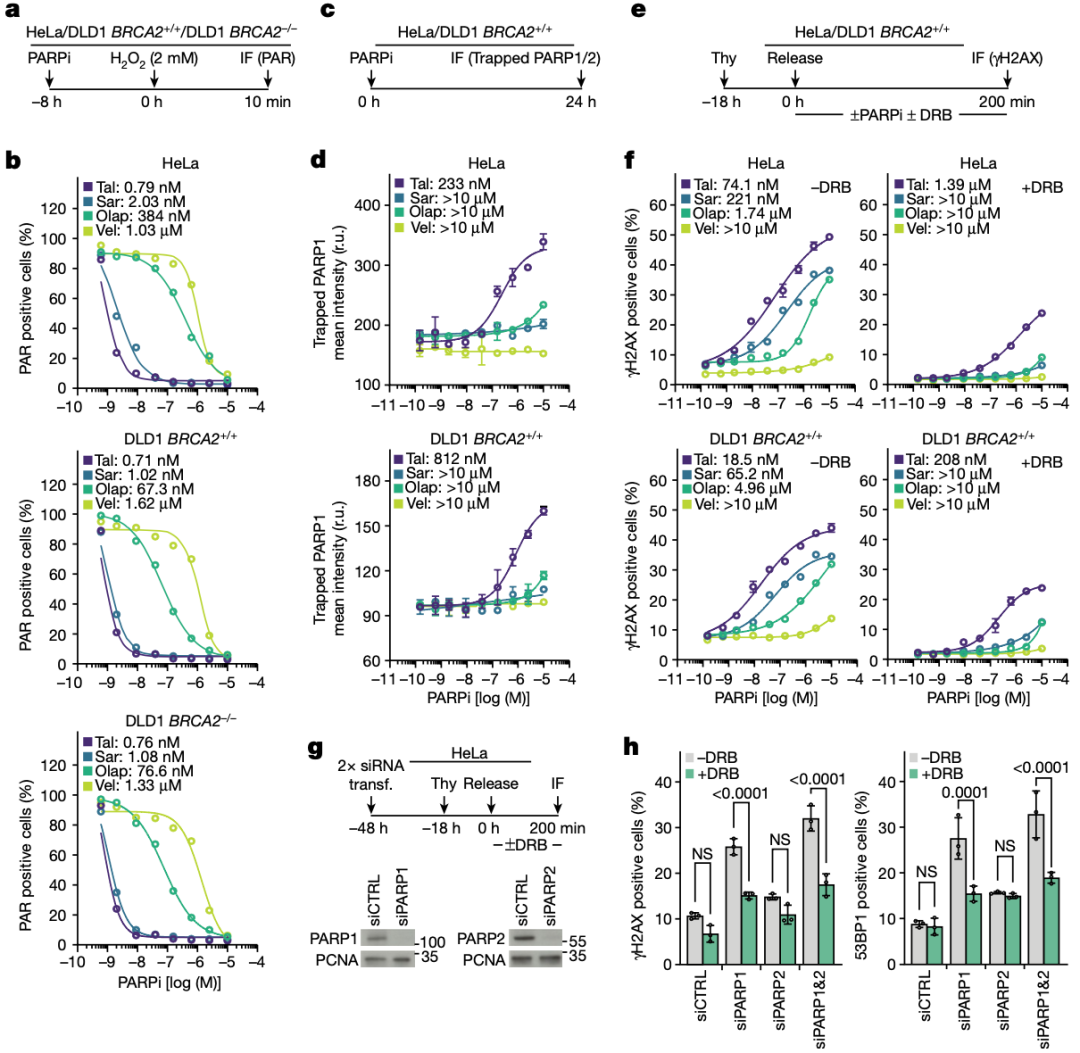
▲ 三者的相关性
后续的机制研究表明,PARP1会向TIMELESS和TIPIN发出即将发生转录-复制冲突的信号,暂停复制体,直到转录-复制冲突被解决。如果PARP1→TIMELESS/TIPIN这条线失灵了,转录-复制冲突就会发生,并导致DNA损伤,需要启动同源重组修复;如果同源重组修复不幸也失灵了,癌细胞就只有死路一条了。
至于PARP抑制剂导致的PARPs被DNA捕获这一问题,Halazonetis团队发现,仅仅抑制PARP1酶活性就足以诱导同源重组缺陷细胞的死亡。这说明,PARP抑制剂诱导的PARPs捕获并不是必要的。此外,鉴于PARPs捕获与细胞毒性有关,他们还认为降低捕获潜能可减少PARP抑制剂的毒性,而不影响疗效。
总的来说,Thanos D. Halazonetis团队的这项研究成果,让我们对PARP抑制剂“合成致死”的机制有了全新的认知。更重要的是,这一分子层面机制的发现,对于未来新型PARP抑制剂的研发提供了指导,也为与同源重组缺陷具有“协同致死”效果的新药研发提供了新的可选靶点。
参考文献:
[1].Petropoulos M, Karamichali A, Rossetti GG, et al. Transcription-replication conflicts underlie sensitivity to PARP inhibitors. Nature. 2024;628(8007):433-441. doi:10.1038/s41586-024-07217-2
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


