鼠源的乳酸脱氢酶D的研究获进展
来源:分子细胞卓越中心 2023-11-06 09:34
乳酸是重要的代谢物,根据其C2原子的手性可分为L-乳酸和D-乳酸两种对映异构体。人体中,过量的L-和D-乳酸的积累会导致乳酸酸中毒。
《自然-通讯》(Nature Communications)在线发表了中国科学院分子细胞科学卓越创新中心丁建平研究组完成的最新研究成果(Lactate dehydrogenase D is a general dehydrogenase for D-2-hydroxyacids and is associated with D-lactic acidosis)。该工作对鼠源的乳酸脱氢酶D(LDHD)进行了系统的生化研究,并解析了LDHD与FAD、Mn2+和一系列底物或产物的复合物的晶体结构。结构和生化数据共同揭示了LDHD的底物特异性和催化机制以及LDHD突变在D-乳酸酸中毒症发生中的作用。
乳酸是重要的代谢物,根据其C2原子的手性可分为L-乳酸和D-乳酸两种对映异构体。人体中,过量的L-和D-乳酸的积累会导致乳酸酸中毒。D-乳酸酸中毒通常被认为是短肠综合征的并发症,发生在恶性肿瘤、疾病或空肠回肠旁路手术切除部分小肠后。虽然L-乳酸和D-乳酸均可以通过血脑屏障,但与L-乳酸不同,D-乳酸在大脑中的积累具有神经毒性作用,导致多种神经系统症状,这些症状往往与原发性神经系统疾病混淆。目前,D-乳酸酸中毒症的发病原因尚不清晰。
近日,在研究患有神经系统症状或伴有常染色体隐性痛风和高尿酸血症的病人中,科研人员发现了LDHD的几种错义突变。代谢谱分析显示,这些病人的尿液和血浆中D-乳酸以及其他几种有机酸的浓度显著升高。有研究推测,这些疾病相关的突变会导致LDHD功能丧失,致使尿液和血浆中D-乳酸以及其他有机酸的水平升高。至今,LDHD的结构、功能、底物特异性和催化反应的分子基础尚不清楚,LDHD突变在D-乳酸酸中毒症发病机制中的作用有待研究。
丁建平组对鼠源的LDHD的酶学特性进行了系统的生化研究。实验结果表明,LDHD对D-乳酸表现出脱氢酶活性,但对L-乳酸没有活性。此外,LDHD对多种C2原子上带有疏水基团的D-2-羟基酸具有酶活,但对C2原子上带有亲水基团的D-2-羟基酸无酶活。结构分析显示,LDHD的底物结合口袋由一个带正电的subsite A和一个疏水的subsite B组成。subsite A结合Mn2+和底物的乙醇酸基团或产物的乙醛酸基团,而subsite B结合底物或产物的疏水基团。对与疾病相关的LDHD突变体的活性分析结果显示,这些突变均导致LDHD对底物的活性降低。结构和生化数据表明,LDHD是一种Mn2+依赖的广谱性脱氢酶,可以催化多种C2原子上带有疏水基团的D-2-羟基酸的脱氢反应。基于结构和生化结果,该研究揭示了LDHD的底物识别和催化机制,阐明了LDHD突变在D-乳酸酸中毒症发生中的作用。该成果为LDHD突变导致的D-乳酸酸中毒症的诊断提供了新方向,并为这一疾病的治疗和相关药物研发奠定了结构基础、提供了理论依据。此外,该工作提示LDHD或在支链氨基酸的代谢中发挥重要作用。
研究工作得到国家自然科学基金委员会和中国科学院的资助,并获得分子细胞卓越中心分子生物学技术平台和上海同步辐射光源线站的协助。
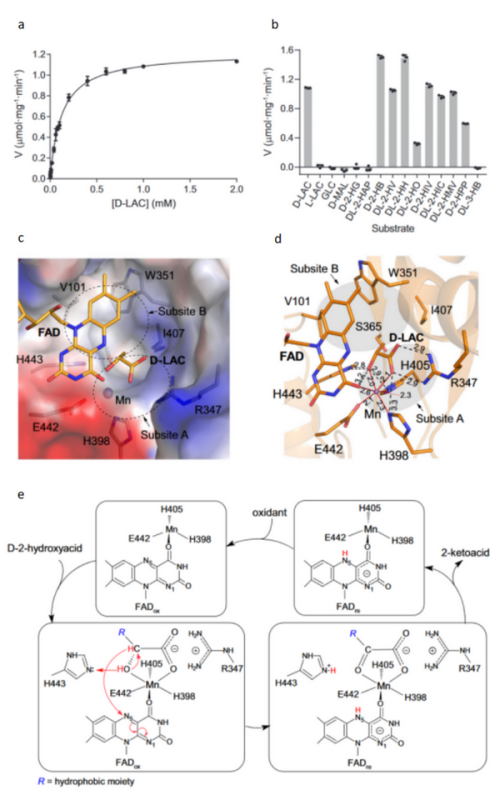
LDHD的酶学性质、活性位点识别底物的结构基础以及催化反应的分子机制。a、LDHD催化D-LAC的饱和曲线;b、LDHD对不同底物和类似物的催化活性;c、LDHDFAD+Mn+D-LAC结构中底物结合位点的表面电势示意图,底物结合位点由亲水性的subsite A和疏水性的subsite B组成;d、LDHDFAD+Mn+D-LAC结构中D-乳酸、FAD、Mn2+和周围氨基酸残基之间的相互作用关系,氢键相互作用用黑色虚线表示,配位键用红色实线表示;e、LDHD的催化反应机制。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


