Cell子刊:西湖大学马仙珏团队揭示Ire1在肿瘤起始过程中决定细胞命运的机制
来源:生物世界 2023-11-13 11:08
西湖大学马仙珏团队在 Cell Reports 期刊发表了题为:Differential Ire1 determines loser cell fate in tumor-suppressive ce
西湖大学马仙珏团队在 Cell Reports 期刊发表了题为:Differential Ire1 determines loser cell fate in tumor-suppressive cell competition 的研究论文。
该研究发现,未折叠蛋白反应感应器——肌醇需求酶1(Inositol-requiring enzyme 1,Ire1)在肿瘤抑制性细胞竞争中决定了细胞的命运,并且不同水平的Ire1依赖机制也有所不同。Cell Reports 还于同期发表了“Q&A with Xianjue Ma” 的文章,介绍了马仙珏的科研方向和职业生涯,并突出介绍了团队的此项工作。

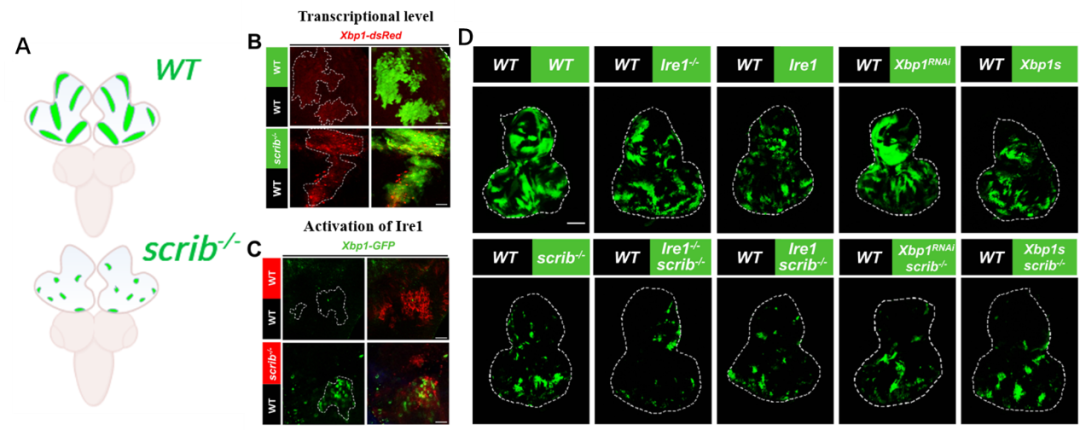
适者生存讲的是不同生物个体之间的竞争,而同一个体的不同细胞间也同样存在着竞争,这种通过持续监测细胞适应性状况并清除适应性较低细胞的过程叫做“细胞竞争” (cell competition,CC)。被清除的细胞通常定义为失败者“Loser”, 存活下来的细胞则定义为优胜者“Winner”。
在癌症起始及进展过程中,并不是所有携带致癌性突变的细胞都会最终形成恶性肿瘤,相反地,很多致癌细胞会被周围野生型细胞通过竞争机制所清除,这个过程叫做肿瘤抑制性细胞竞争。
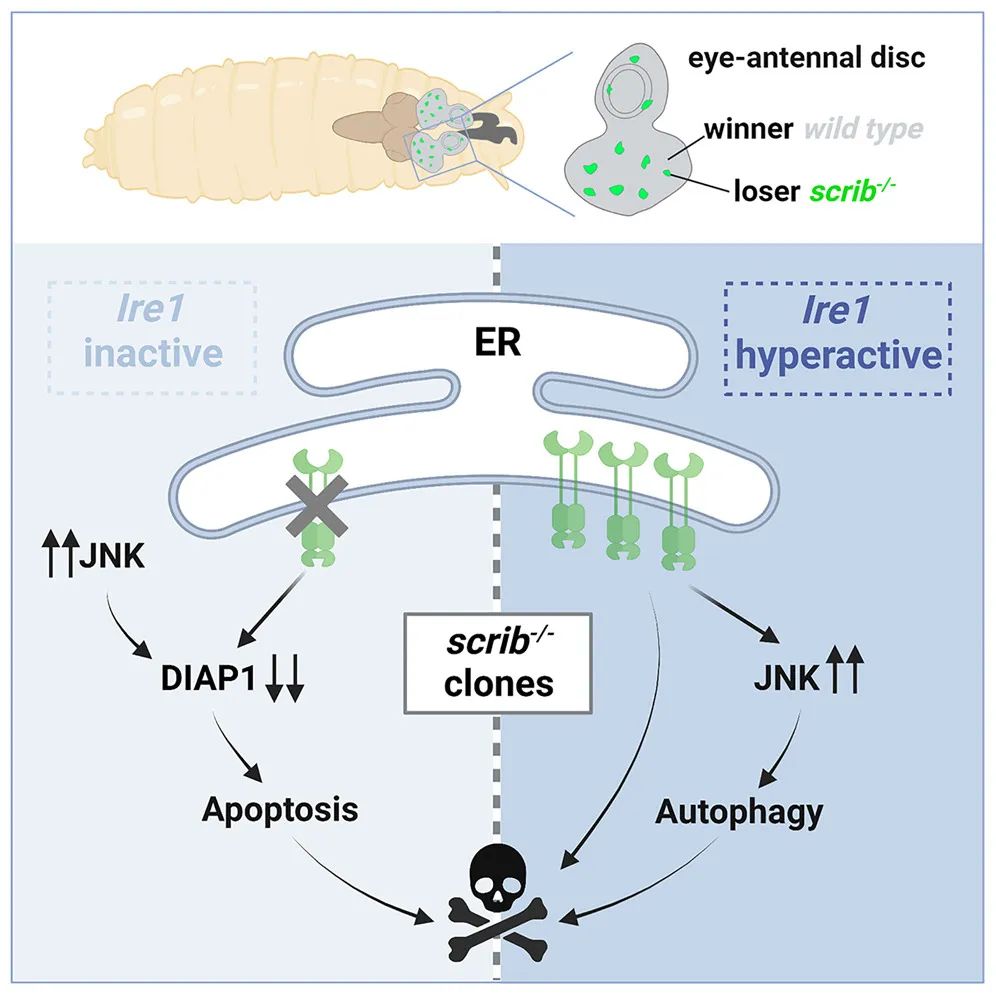
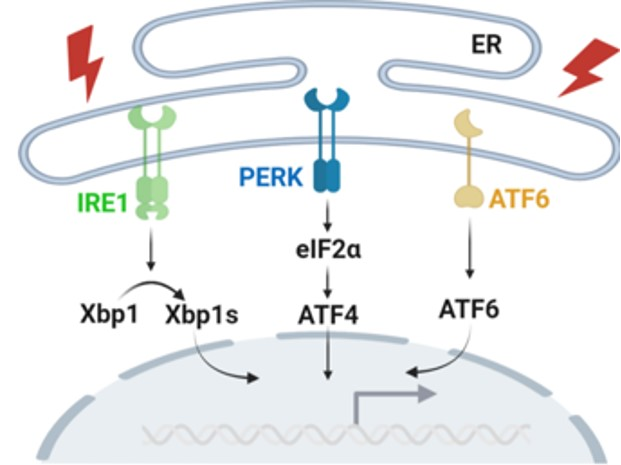
肿瘤细胞在增殖过程中对蛋白质合成的巨大需求远超出内质网(ER)的加工和折叠能力,这就导致了内质网应激(ER stress)并随后激活未折叠蛋白质反应(unfolded protein response,UPR),以便缓解应激从而维持细胞稳态。UPR包括三个信号分支:Ire1/Xbp1s、Perk/Atf4和Atf6,其中Ire1在进化上最为保守,是人类癌症中五种突变率最高的激酶之一。
研究表明,Ire1对肿瘤发生有双重调控作用,既能抑制也能促进肿瘤发生,但值得注意的是这些研究多数依赖于体外培养细胞和移植肿瘤模型,而忽略了肿瘤所处环境中周围细胞的潜在作用和影响。因此,需要建立一个精细的体内遗传模型来系统性地解析UPR在调控肿瘤起始中的功能。
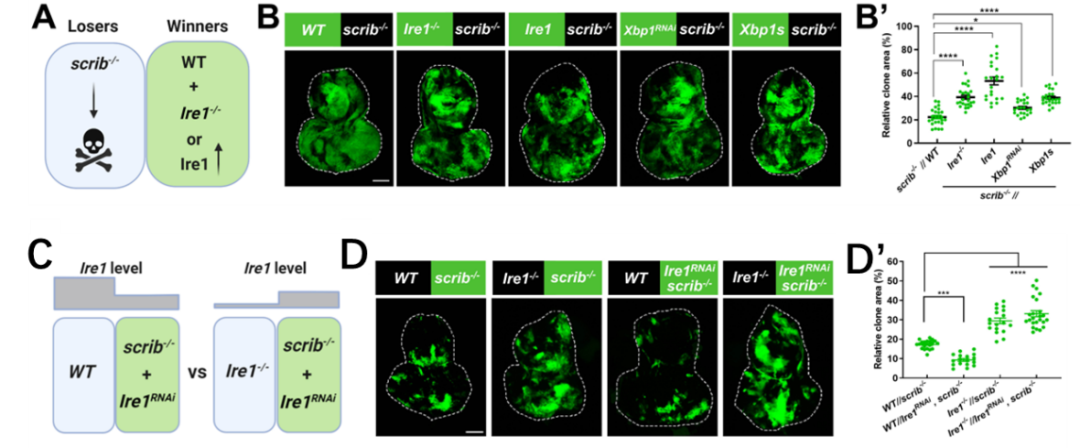
最后,为了探究Ire1在哺乳动物中是否也调控细胞竞争,团队利用犬肾细胞(MDCK)建立了E-钙粘蛋白(E-cadherin, E-cad)过表达诱导的细胞竞争模型。在周围存在野生型细胞时,过表达E-cad的细胞适应性较差,会变成loser;如果在过表达E-cad的同时敲低ERN1(Ire1同源物),则能显著提高loser细胞的生存能力。
综上,该研究利用果蝇scrib缺失诱导的肿瘤抑制性细胞竞争模型,揭示了Ire1调控细胞竞争的机制:Ire1的缺失通过促进loser细胞的凋亡来清除它们;而Ire1的激活更倾向于通过自噬依赖的方式清除loser细胞。此外,团队还发现Irel/ERN1在哺乳动物细胞竞争中同样重要,但其具体调控机制还需要进一步探究。
西湖大学2021级博士研究生郑嘉东、2020级博士研究生郭一帆及2022级博士研究生施畅翼为论文共同第一作者,西湖大学马仙珏研究员和西湖大学助理研究员许纹衍为论文通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


