《癌细胞》:帮CD8+T细胞“招兵买马”,竟然是免疫治疗抗癌成功的关键!
来源:奇点糕 2024-05-30 10:44
荷兰研究者们在两种不同的实体瘤模型小鼠身上证实,使用免疫治疗后CD8+T细胞和M1型TAMs,以及NK细胞、中性粒细胞等免疫细胞涌入肿瘤的数量,与免疫治疗的应答呈正相关性。
近日,荷兰莱顿大学研究者们就在《癌细胞》上发表了一项让人颇感欣慰的最新研究成果,CD8+T细胞可算是学会找TAMs当帮手了,但前提还得是免疫治疗的“赋能”:被免疫治疗激活的CD8+T细胞会通过趋化因子受体CCR5信号,将巨噬细胞募集到肿瘤部位,并将它们向有利抗肿瘤免疫的M1型极化,这部分M1型TAMs对免疫治疗的见效至关重要。
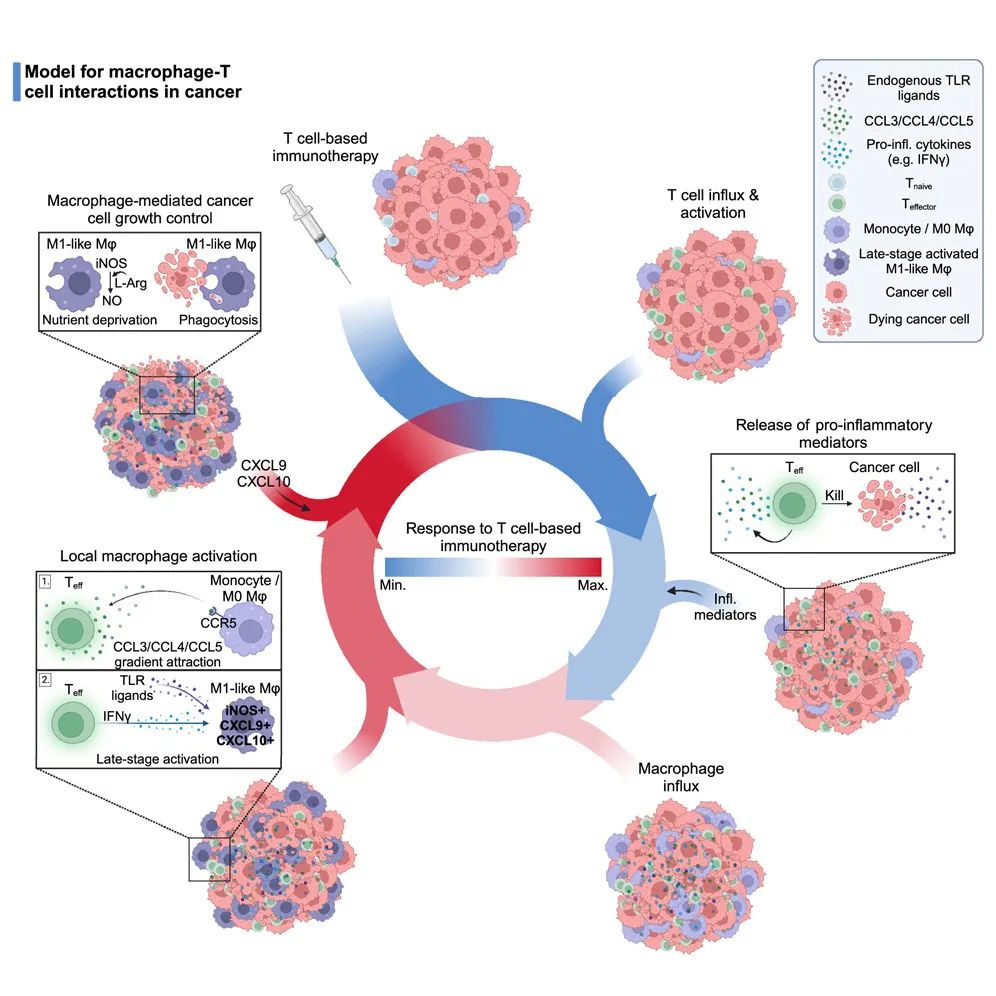
论文核心内容总结
虽说T细胞和巨噬细胞都是抗肿瘤免疫中频频出镜的重要免疫细胞亚群,但仔细回想一下,过去的基础科研很少探索它们之间的相互作用,大多数研究都在探索T细胞和巨噬细胞各自“纵向”受到的影响,轻视了横向关系这一环。
而在本次研究中,荷兰研究者们首先在两种不同的实体瘤模型小鼠身上证实,使用免疫治疗后CD8+T细胞和M1型TAMs,以及NK细胞、中性粒细胞等免疫细胞涌入肿瘤的数量,与免疫治疗的应答呈正相关性,且在CD8+T细胞数量和激活状态未明显下降的前提下,清除掉M1型TAMs就足以使免疫治疗失效,但清除NK细胞就不会有类似的显著影响。
从这一点来说,M1型TAMs也可以被视为免疫治疗“效应细胞”,而清除掉CD8+T细胞则会使M1型TAMs在肿瘤微环境中完全消失,说明它们的出现是以CD8+T细胞被免疫治疗激活为前提;此消彼长,M1型TAMs消失后,不利于抗癌的M2型TAMs就占了上风。
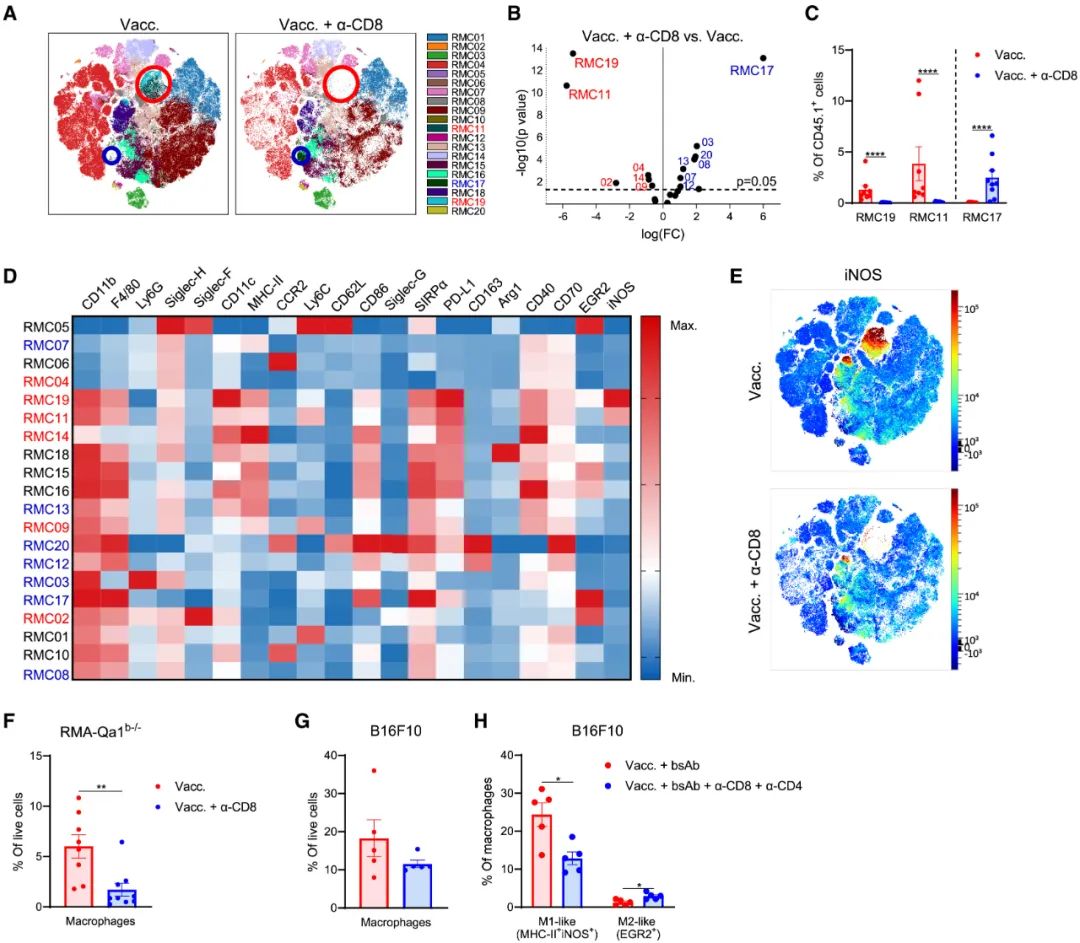
清除CD8+T细胞后,M1型TAMs在肿瘤微环境中也会消失
为明确证实CD8+T细胞对TAMs的调控作用,研究者们使用肿瘤抗原激活的小鼠脾脏CD8+T细胞培养上清液,来处理幼稚的骨髓来源巨噬细胞(BMDMs),这些BMDMs就很快开始向M1型TAMs极化,表现为诱导性一氧化氮合酶(iNOS)、CD86、PD-L1等特征性标志物的表达显著上升,而直接从瘤内分离的CD8+T细胞也有类似的诱导极化作用。
由于研究者们在实验中,会先使用治疗性肿瘤疫苗激活CD8+T细胞主导的免疫应答,并同时使一部分巨噬细胞向M1型TAMs极化,而CD8+T细胞再激活M1型TAMs在时间顺序上要晚一些,研究者们就把被CD8+T细胞激活的M1型TAMs命名为“后期激活的M1型TAMs”,iNOS表达上调是这部分M1型TAMs的独有特征。
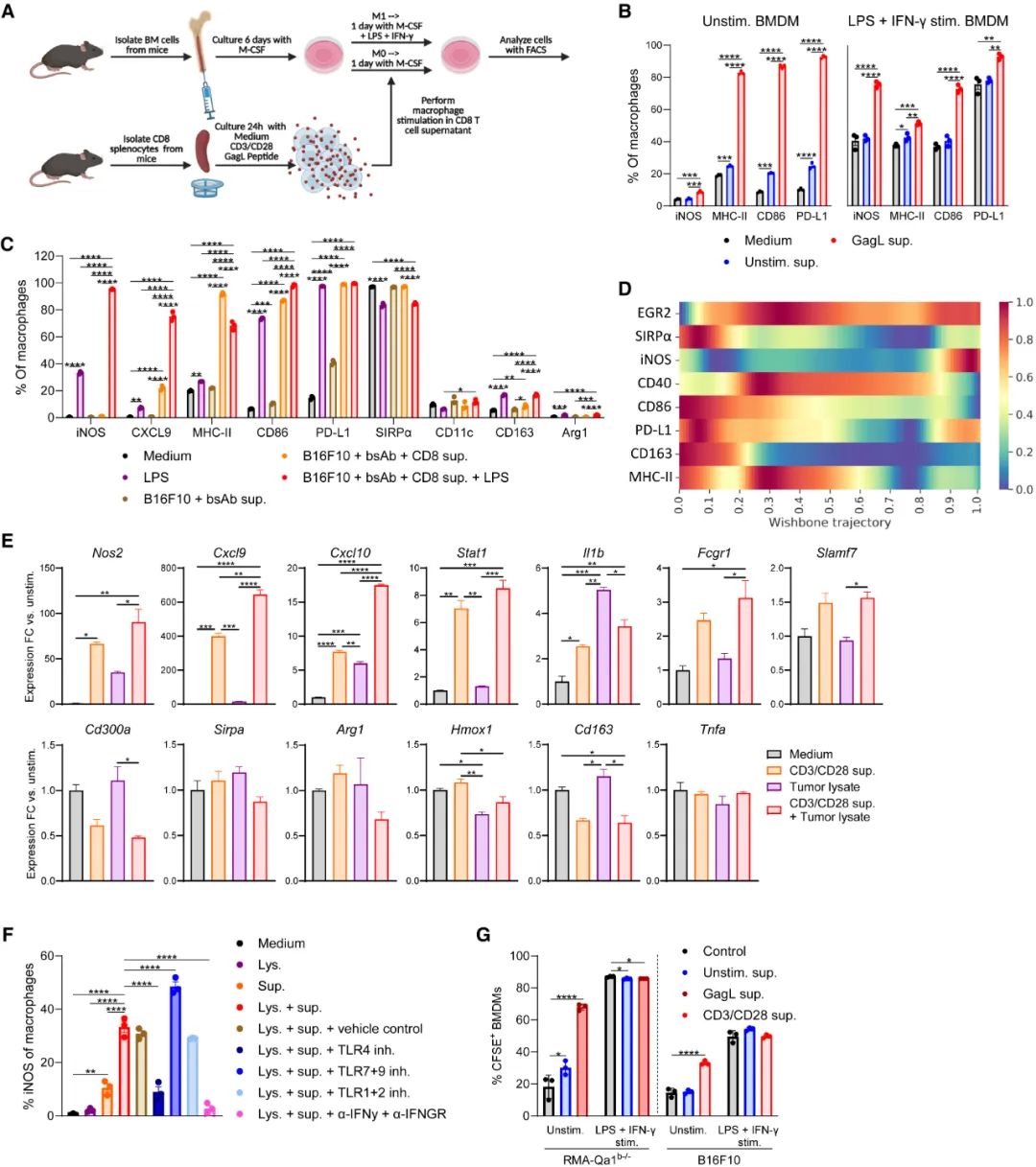
CD8+T细胞可诱导巨噬细胞向M1型TAMs极化
而CD8+T细胞对巨噬细胞的“规训”,或者说诱导极化则主要依赖两条途径,其一是杀死癌细胞后,癌细胞裂解物(tumor cell lysate)能有效激活iNOS阳性巨噬细胞;第二条途径则更为重要:CD8+T细胞分泌的趋化因子CCL3/CCL4/CCL5显著增多,它们会与巨噬细胞表面相应的受体CCR5结合,使巨噬细胞被募集到CD8+T细胞附近,再接受CD8+T细胞分泌的干扰素-γ(IFNγ)信号,开始表达iNOS这个关键的标志物。
接下来,后期激活的M1型TAMs也会用两种招数抗癌,通过增强胞吞作用消灭癌细胞很好理解,但研究者们还意外发现,后期激活的M1型TAMs高表达的iNOS也很重要,但iNOS并非通过释放一氧化氮、造成细胞毒性杀伤癌细胞,而是给癌细胞施加代谢压力:iNOS会将肿瘤微环境中的L-精氨酸转化为L-瓜氨酸,让癌细胞缺乏L-精氨酸这一关键营养物。
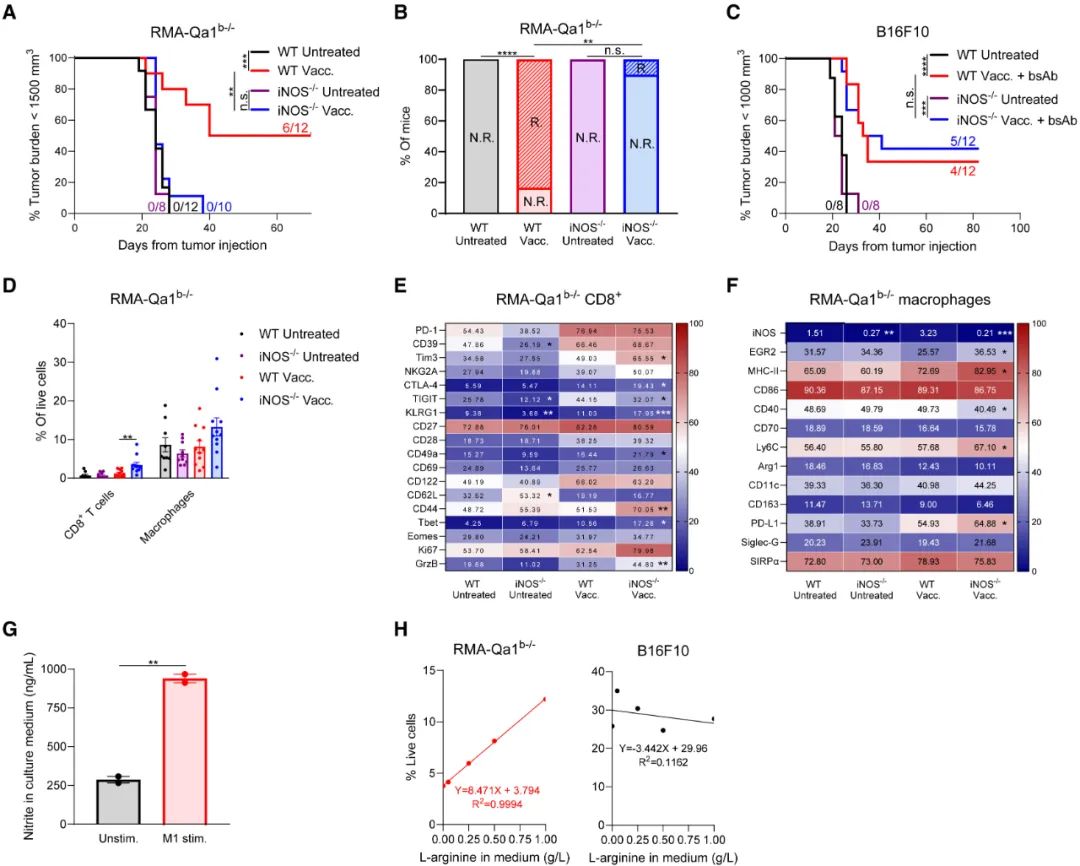
iNOS会将肿瘤微环境中的L-精氨酸转化为L-瓜氨酸,给癌细胞施加代谢压力
最后研究者们也证实,上述在小鼠实验中找到的“后期激活的M1型TAMs”,在多种人类实体瘤中也普遍存在,且与免疫检查点抑制剂的治疗应答有明确相关性,如果患者肿瘤能检出CCL3/CCL4/CCL5三种CCR5配体,那就说明存在后期激活的M1型TAMs,是利好免疫治疗的信号,下一步就该想想怎么让M1型TAMs在免疫治疗中贡献更多力量啦。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


