Nat Immunol:周荣斌团队报道靶向组织驻留NK的肿瘤免疫治疗新策略和新靶点
来源:生物探索 2024-10-08 13:09
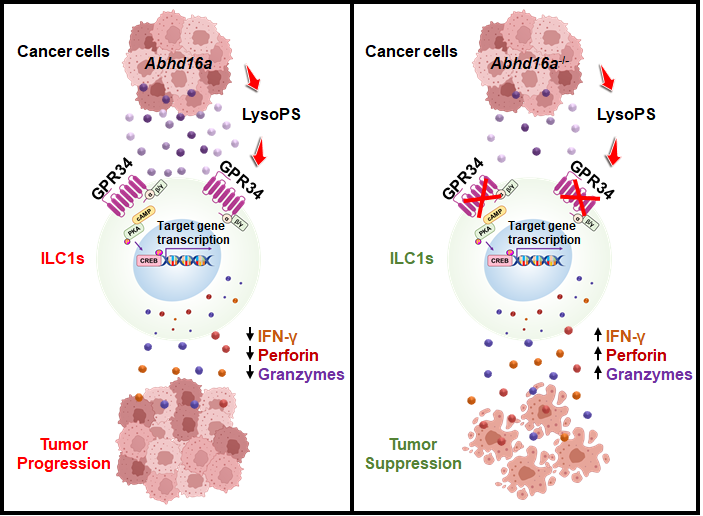
该研究发现肿瘤来源的脂质代谢物LysoPS可通过其受体GPR34抑制ILC1s的抗肿瘤活性,而拮抗GPR34可增强 ILC1s的抗肿瘤活性并抑制肿瘤生长。
中国科学技术大学生命科学与医学部、免疫应答与免疫治疗重点实验室周荣斌/江维/王夏琼团队在Nature Immunology在线发表题为GPR34 is a metabolic immune checkpoint for ILC1-mediated antitumor immunity的研究论文,报道了肿瘤来源的脂质代谢物溶血磷脂酰丝氨酸(LysoPS)可通过其受体GPR34抑制ILC1s的抗肿瘤活性,而拮抗GPR34受体可以诱导强效的ILC1s介导的抗肿瘤免疫从而抑制肝癌、结直肠癌等实体肿瘤生长。

在该项研究中,研究人员通过构建tdTomato-GPR34报告鼠,发现GPR34在ILC1s上高表达,而在cNK细胞上不表达,提示GPR34可以作为一个新的区分ILC1s和cNK的标志物。进一步利用多种不同的皮下瘤和结肠癌肝转移的原位瘤模型,研究人员发现GPR34全身基因缺陷或ILC1s条件缺陷均能增加肿瘤中ILC1s的比例、数目和抗肿瘤活性,并抑制肿瘤生长,表明GPR34通过抑制ILC1s的抗肿瘤活性来促进肿瘤生长。
接下来,研究人员探究了GPR34调控 ILC1s介导的抗肿瘤免疫的机制。通过质谱检测,发现GPR34配体LysoPS在肿瘤间质液积累。体外实验表明LysoPS以GPR34依赖的方式通过cAMP-PKA-CREB 途径抑制ILC1s的活化。敲低肿瘤细胞上LysoPS合成酶ABHD16A的表达可以降低肿瘤间质液中LysoPS的水平并抑制了肿瘤的生长。此外,抑制肿瘤中LysoPS的产生可增加肿瘤中ILC1s的数量、比例以及抗肿瘤活性。这些结果表明,肿瘤来源的LysoPS通过GPR34抑制ILC1s介导的肿瘤免疫从而促进肿瘤生长。
进一步的研究发现,不管是在皮下肿瘤模型还是肝转移模型中,利用抑制剂阻断GPR34均可抑制肿瘤生长,且GPR34抑制剂与抗TIGIT抗体联合使用可提高肿瘤治疗的效率。
最后,研究人员探讨了LysoPS-GPR34-ILC1s通路在人类癌症中的临床相关性,发现GPR34 mRNA在结肠腺癌、头颈癌或肝细胞癌患者肿瘤组织中的ILC1样细胞上高表达,而在cNK细胞上表达较低,且ABHD16A和GPR34的表达与癌症患者ILC1s的抗肿瘤活性呈负相关性。
模式图(Credit: Nature Immunology)
综上所述,该研究发现肿瘤来源的脂质代谢物LysoPS可通过其受体GPR34抑制ILC1s的抗肿瘤活性,而拮抗GPR34可增强 ILC1s的抗肿瘤活性并抑制肿瘤生长。研究的创新性体现在:1)率先证明靶向ILC1s(组织驻留NK)可以诱导抗肿瘤免疫并抑制肿瘤生长,提示靶向组织驻留的免疫细胞对实体肿瘤可能为一种潜在的有效策略;2)发现危险信号感应受体GPR34为一个新的代谢免疫检查点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


